【适应症】
MONJUVI是CD19定向的溶细胞抗体,与来那度胺(lenalidomide)联合治疗未作说明的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL),包括由低级淋巴瘤引起的DLBCL,并且不适合自体干细胞移植(ASCT)的成人患者。
【推荐剂量】
- 在开始开始MONJUVI之前,应先进行治疗前用药。
- MONJUVI的推荐剂量为12 mg / kg,根据以下给药时间表进行静脉输注:(2.1)
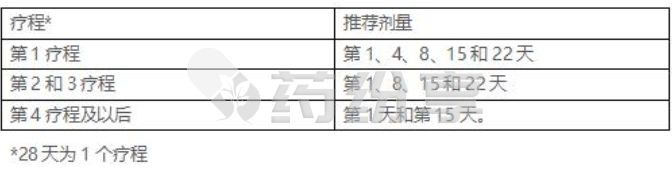
Ø 第1疗程:每个疗程的第1、4、8、15和22天。28天为1疗程。
Ø 第2和3疗程:每个疗程的第1、8、15和22天。28天为1疗程。Ø 第4疗程及以后:每个疗程的第1天和第15天。28天为1疗程。
- MONJUVI与来那度胺(lenalidomide)联合使用的最多12个疗程。然后继续使用MONJUVI作为单一疗法直至疾病进展或不可接受的毒性。
下面是MONJUVI剂量表

【不良反应】
最常见的不良反应(≥20%)是中性粒细胞减少症,疲劳,贫血,腹泻,血小板减少,咳嗽,发热,周围水肿,呼吸道感染,食欲下降。
【药理作用】
Tafasitamab-cxix是一种Fc修饰的单克隆抗体,可与前B淋巴细胞和成熟B淋巴细胞的表面以及包括扩散性大B细胞淋巴瘤(DLBCL)在内的几种B细胞恶性肿瘤中表达的CD19抗原结合。
与CD19结合后,tafasitamab-cxix通过凋亡和免疫效应机制,包括抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP))介导B细胞裂解。
在DLBCL肿瘤细胞中进行的体外研究中,与单独的tafasitamab-cxix或来那度胺相比,tafasitamab-cxix与来那度胺联合导致ADCC活性增加。
【贮藏】
在2°C至8°C (36°F至46°F)的温度下冷藏储存在原纸盒中,以防光线照射。
【有效期】
24个月
【使用方法】
推荐治疗前用药:
在开始MONJUVI输液前30分钟到2小时开始治疗前用药,以减少输液相关反应。治疗前用药可包括对乙酰氨基酚、组胺H1受体拮抗剂、组胺H2受体拮抗剂和/或糖皮质激素。
对于在前3次输液期间没有出现输液相关反应的患者,后续输液治疗前用药可选可不选。
如果在治疗过程中患者出现输液相关反应,则在每次后续治疗前应给予治疗前用药。
灌输。
配药和给药:
输液前重新配制并稀释MONJUVI。
重现配置
1.计算剂量(毫克)并确定所需的小瓶数量。
2.用5mL无菌注射用水)将每个200 mg MONJUVI小瓶重新配制。水流直接朝向每个小瓶壁,最终浓度为40 mg / mL MONJUVI (tafasitamab-cxix)。
3.轻轻旋转小瓶直至完全溶解。 请勿剧烈摇晃或旋转。 完成溶解可能需要5分钟。
4.目视检查重新配制的溶液中是否有颗粒物或变色。 重新配置的溶液应显示为无色至浅黄色溶液。如果溶液浑浊,变色或含有可见颗粒则丢弃小瓶。
5.立即使用重新配制的MONJUVI溶液。 如果需要,存储小瓶中重新配制的溶液最多12小时,在2°C至8°C (36°F至46°F)温度下冷藏或在20°C至25°C (68°F至77°F)之间室温下均可。存放期间要避光。
稀释
1.根据所需剂量确定所需的40 mg / mL MONJUVI重新配置溶液的体积(mL)。
2.从250 mL 0.9%氯化钠注射液输液袋中取出等于所需MONJUVI溶液的体积,并丢弃。
3.取出必要量的MONJUVI,并在装有0.9%氯化钠注射液USP的输液袋中缓慢稀释至终浓度2 mg / mL至8 mg / mL。丢弃残留在样品瓶中的未使用的MONJUVI残留部分。
4.缓慢颠倒输液袋轻轻混合。不要摇晃。给药前,目视检查输液袋中稀释的MONJUVI溶液是否有颗粒物和变色。
5.如果不立即使用,将稀释的MONJUVI溶液在2°C至8°C (36°F至46°F)下冷藏最多18小时,和/或在室温下于20°C至25°C (68°F -77°F)冷藏最多12小时。室温储存包括输液时间。存放期间要避光。
不要摇动或冷冻重新配制或稀释的输液。
给药:
- 以静脉输液的方法给予MONJUVI。
* 对于第一次输液,在前30分钟内使用70 mL / h的输液速度,然后增加输液速度,在1.5到2.5小时内完成输液。
* 在1.5至2小时内完成所有后续输液。
- 将输液袋中的所有MONJUVI液体全部输注完。
- 请勿通过同一输液管路共同使用其他药物。
- 未发现MONJUVI与以下材质输液容器之间不相容:聚丙烯(PP)、聚氯乙烯(PVC)、聚乙烯(PE)、聚对苯二甲酸乙二醇酯(PET)或聚氨酯(PUR)或PVC制成的玻璃和输液器。
【推荐剂量】
- 在开始开始MONJUVI之前,应先进行治疗前用药。
- MONJUVI的推荐剂量为12 mg / kg,根据以下给药时间表进行静脉输注:(2.1)
Ø 第1疗程:每个疗程的第1、4、8、15和22天。28天为1疗程。
Ø 第2和3疗程:每个疗程的第1、8、15和22天。28天为1疗程。
Ø 第4疗程及以后:每个疗程的第1天和第15天。28天为1疗程。
- MONJUVI与来那度胺(lenalidomide)联合使用的最多12个疗程。然后继续使用MONJUVI作为单一疗法直至疾病进展或不可接受的毒性。
下面是MONJUVI剂量表

*28天为1个疗程
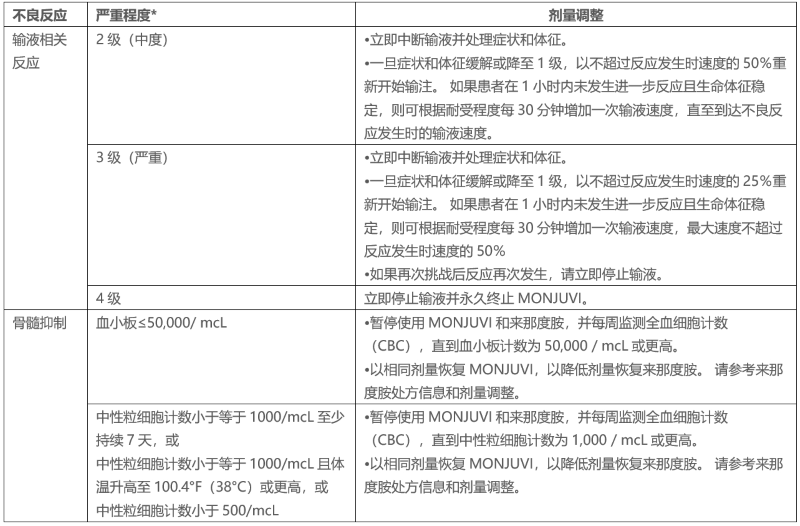
【剂量调整】
表1总结了MONJUVI相关不良反应的剂量调整方法。
表1.不良反应的推荐剂量调整
【延迟或遗漏给药】
如果您错过任何预约,请尽快致电您的医疗保健提供者以重新安排预约。
【过量处理】
无相关信息
【不良反应】
最常见的不良反应(≥20%)是中性粒细胞减少症,疲劳,贫血,腹泻,血小板减少,咳嗽,发热,周围水肿,呼吸道感染,食欲下降。
【注意事项】
•输液相关反应:在输液期间经常监视患者。 根据严重程度中断或中止输液。
•骨髓抑制:监测全血细胞计数。 使用剂量调整和生长因子支持进行管理。 根据严重性中断或中止MONJUVI。
•感染:MONJUVI期间和之后可能发生细菌,真菌和病毒感染。 监视患者的感染情况。
•胚胎-胎儿毒性:可能引起胎儿伤害。 告知育龄期女性潜在的胎儿风险并建议使用有效的避孕措施。
【禁忌】
无相关信息
【特殊人群】
妊娠期:根据其作用机制,本品给孕妇服用时可能会导致胎儿B细胞耗竭。
哺乳期:建议女性在本品治疗期间以及最后一次给药后至少3个月内不要母乳喂养。更多信息,请参阅来那度胺处方信息。
儿童:本品在儿科患者中的安全性和有效性尚未确定。
老年患者:本品的临床研究没有包括足够数量的65岁及以上患者,以确定其疗效是否与年轻受试者不同。65岁及以上的患者(57%)比年轻患者(39%)有更严重的不良反应。
【适应症】
MONJUVI是CD19定向的溶细胞抗体,与来那度胺(lenalidomide)联合治疗未作说明的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL),包括由低级淋巴瘤引起的DLBCL,并且不适合自体干细胞移植(ASCT)的成人患者。
【药物相互作用】
无相关信息
请按药品说明书或在药师指导下购买和使用



 在线咨询
在线咨询 400-001-9769
400-001-9769
