【适应症】
本品是一种核苷代谢抑制剂,适用于经强化诱导化疗后达到首次完全缓解(CR)或伴不完全血液学恢复的完全缓解(CRi)、且无法完成强化治愈性治疗的急性髓系白血病成人患者的持续治疗。
【推荐剂量】
不可用本品替代静脉内或皮下注射用阿扎胞苷。本品的适应症和给药方案与静脉内或皮下注射用阿扎胞苷不同。
推荐剂量:每个28天周期的第 1 至 14 天给药,每次300mg,口服,每日1次,可带或不带食物服用。直至疾病出现进展或发生不可耐受的毒性。
止吐药使用:至少在最初 2 个周期内,每次给药前需给予止吐药。若 2 个周期后未出现恶心呕吐,可停止止吐预防用药。
若周期第 1 天的绝对中性粒细胞计数(ANC)低于 0.5×10⁹/ 升,不得给药。需延迟周期开始时间,直至 ANC≥0.5×10⁹/ 升。
【药理作用】
阿扎胞苷是胞苷的嘧啶核苷类似物,可抑制 DNA/RNA 甲基转移酶。阿扎胞苷经细胞摄取并经酶促生物转化为三磷酸核苷酸后,掺入 DNA 和 RNA 中。
在体外,阿扎胞苷掺入包括急性髓系白血病细胞在内的癌细胞 DNA 中,可抑制 DNA 甲基转移酶、降低 DNA 甲基化并改变基因表达(包括重新表达调控肿瘤抑制和细胞分化的基因);掺入癌细胞(包括白血病细胞)RNA 中,可抑制 RNA 甲基转移酶、降低 RNA 甲基化、减少 RNA 稳定性并降低蛋白质合成。
体外试验中,阿扎胞苷通过降低细胞活力和诱导急性髓系白血病细胞系凋亡展现抗白血病活性;体内白血病肿瘤模型中,阿扎胞苷可减少肿瘤负荷并延长生存期。
【贮藏】
-储存温度:20℃至 25℃(68℉至 77℉),允许在 15℃至 30℃(59℉至 86℉)之间波动。
-保持瓶盖紧闭,在原包装(含 2 个干燥剂罐)中储存和分发。
-置于儿童无法触及之处。
【有效期】
30个月
【使用方法】
-本品仅供口服用药。
-不得掰开、压碎或咀嚼 本品片剂。
-每日约在同一时间服药。
【推荐剂量】
不可用本品替代静脉内或皮下注射用阿扎胞苷。本品的适应症和给药方案与静脉内或皮下注射用阿扎胞苷不同。
推荐剂量:每个28天周期的第 1 至 14 天给药,每次300mg,口服,每日1次,可带或不带食物服用。直至疾病出现进展或发生不可耐受的毒性。
止吐药使用:至少在最初 2 个周期内,每次给药前需给予止吐药。若 2 个周期后未出现恶心呕吐,可停止止吐预防用药。
若周期第 1 天的绝对中性粒细胞计数(ANC)低于 0.5×10⁹/ 升,不得给药。需延迟周期开始时间,直至 ANC≥0.5×10⁹/ 升。
【剂量调整】
最初 2 个周期每两周监测一次全血细胞计数,之后每个周期开始前监测一次。
若因骨髓抑制降低剂量,后续 2 个周期需每两周增加一次监测频率。
不良反应的推荐剂量调整如下表所示: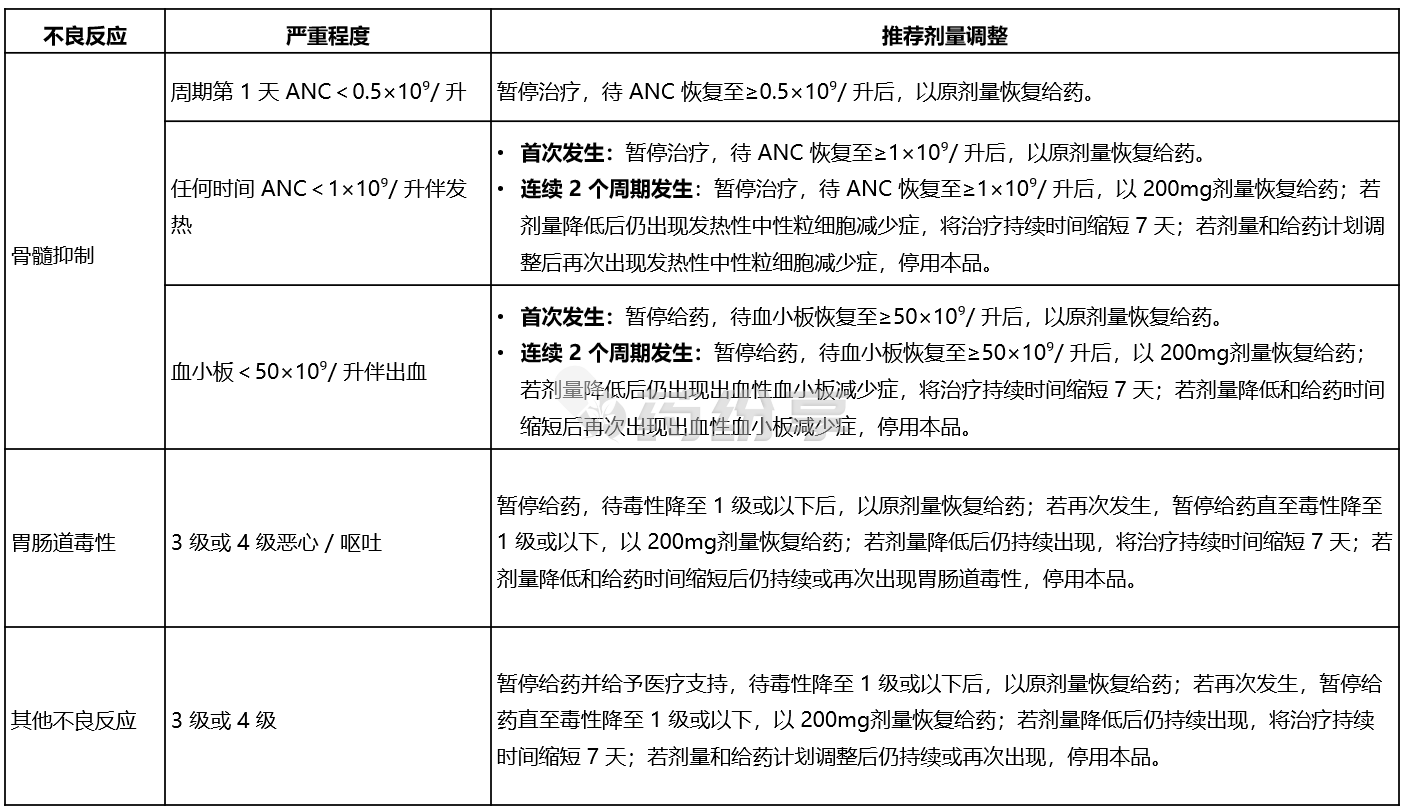
【服用过量处理】
无
【漏服处理】
-若漏服或未按常规时间服药,应在当日尽快补服,次日恢复正常给药计划,不可在同一日服用 2 剂。
-若服药后呕吐,同一日不得再次服药,次日恢复正常给药计划。
【不良反应】
最常见的不良反应:恶心、呕吐、腹泻、疲劳 / 乏力、便秘、肺炎、腹痛、关节痛、食欲减退、发热性中性粒细胞减少症、头晕和肢体疼痛。
【注意事项】
-与其他阿扎胞苷制剂的替代风险
由于药代动力学参数存在显著差异,ONUREG 的推荐剂量和给药方案与静脉内或皮下注射用阿扎胞苷不同。以 ONUREG 的推荐剂量使用静脉内或皮下注射用阿扎胞苷可能导致致命不良反应;以静脉内或皮下注射用阿扎胞苷的剂量使用 ONUREG 可能无效。不可用 ONUREG 替代静脉内或皮下注射用阿扎胞苷。
- 骨髓抑制
接受 ONUREG 治疗的患者中,49% 和 22% 分别出现新的或加重的 3 级或 4 级中性粒细胞减少症和血小板减少症,12% 出现发热性中性粒细胞减少症。7% 和 2% 的患者分别因中性粒细胞减少症和血小板减少症需要降低剂量,不足 1% 的患者因上述不良反应停用 ONUREG。需监测全血细胞计数并按推荐调整剂量,若出现骨髓抑制,需给予标准支持治疗(包括造血生长因子)。
-骨髓增生异常综合征患者的早期死亡率增加
在 AZA-MDS-003 试验(NCT01566695)中,216 例因骨髓增生异常综合征导致红细胞输注依赖型贫血和血小板减少症的患者被随机分配至 ONUREG 组或安慰剂组。107 例患者接受 ONUREG 300 毫克每日一次、每个 28 天周期给药 21 天的治疗,中位治疗周期为 5 个。由于 ONUREG 组患者的早期致命和 / 或严重不良反应发生率高于安慰剂组,试验提前终止。最常见的致命不良反应为败血症。ONUREG 治疗骨髓增生异常综合征的安全性和有效性尚未确立,不推荐在对照试验外使用 ONUREG 治疗骨髓增生异常综合征。
-胚胎 - 胎儿毒性
基于作用机制和动物研究结果,ONUREG 给予孕妇可能导致胎儿伤害。在低于推荐人体每日口服剂量(按 mg/m² 计算)的单次腹腔注射剂量下,阿扎胞苷可导致妊娠大鼠出现胎儿死亡和畸形。告知孕妇对胎儿的潜在风险;有生殖潜力的女性在治疗期间及最后一剂后至少 6 个月需使用有效的避孕措施;有生殖潜力女性伴侣的男性在治疗期间及最后一剂后至少 3 个月需使用有效的避孕措施。
【禁忌】
对阿扎胞苷或其成分存在严重过敏史者禁用。
【特殊人群】
-妊娠期
基于作用机制和动物研究结果,ONUREG 给予孕妇可能导致胎儿伤害。目前尚无孕妇使用 ONUREG 的可用数据评估药物相关风险。阿扎胞苷在低于推荐人体每日口服剂量(按 mg/m² 计算)时,对动物具有致畸性并导致胚胎 - 胎儿死亡。告知孕妇对胎儿的潜在风险。
-哺乳期:
尚无关于阿扎胞苷是否存在于人乳中、对母乳喂养婴儿或乳汁产生影响的数据。由于母乳喂养婴儿可能出现严重不良反应,建议女性在治疗期间及最后一剂后 1 周内不要母乳喂养。
-育龄男性和女性患者:
妊娠检测:有生殖潜力的女性开始 ONUREG 治疗前需进行妊娠检测。
避孕:有生殖潜力的女性在治疗期间及最后一剂后至少 6 个月需使用有效的避孕措施;有生殖潜力女性伴侣的男性在治疗期间及最后一剂后至少 3 个月需使用有效的避孕措施。
生育力:基于动物数据,ONUREG 可能损害男性或女性的生育力。
-儿科用药:
本品在儿科患者中的安全性和有效性尚未确立。
-老年用药:
老年患者与年轻患者在安全性和有效性方面未观察到总体差异。
-肾功能不全患者:
严重肾功能不全患者(根据 Cockcroft-Gault 公式计算的肌酐清除率(CLcr)为 15 至 29 毫升 / 分钟)需更频繁监测不良反应,并根据不良反应调整 ONUREG 剂量。
轻度至中度肾功能不全患者(CLcr 为 30 至 89 毫升 / 分钟)无需调整 ONUREG 剂量。
-肝功能不全患者:
尚无 ONUREG 在预先存在严重肝功能不全患者中的研究数据。
中度肝功能不全患者(总胆红素>1.5 至 3×ULN)的推荐剂量尚未确立。
轻度肝功能不全患者(总胆红素≤ULN 且 AST>ULN,或总胆红素 1 至 1.5×ULN 且 AST 任意值)无需调整 ONUREG 剂量。
【适应症】
本品是一种核苷代谢抑制剂,适用于经强化诱导化疗后达到首次完全缓解(CR)或伴不完全血液学恢复的完全缓解(CRi)、且无法完成强化治愈性治疗的急性髓系白血病成人患者的持续治疗。
【药物相互作用】
无





 在线咨询
在线咨询 400-001-9769
400-001-9769
