【适应症】
本品是一种激酶抑制剂,与氟维司群联合用于治疗患有激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性、伴有一种或多种生物标志物改变PIK3CA/ AKT1/PTEN 改变的局部晚期或转移性乳腺癌成年患者 ,曾在转移性环境中至少一种基于内分泌的治疗方案出现进展,或在完成辅助治疗后 12 个月内复发。
【推荐剂量】
根据肿瘤组织中是否存在以下一种或多种基因改变(PIK3CA/AKT1/PTEN),选择接受 TRUQAP 治疗 HR 阳性、HER2 阴性晚期或转移性乳腺癌的患者。
-推荐剂量:每次 400 mg,每日口服两次,可与食物同食或单独服用,持续 4 天,然后停药 3 天。
【不良反应】
最常见的不良反应(发生率≥20%),包括实验室异常,为腹泻、皮肤不良反应、随机血糖升高、淋巴细胞减少、血红蛋白降低、空腹血糖升高、恶心、疲劳、白细胞减少、甘油三酯增加、中性粒细胞减少、肌酐升高 、呕吐和口腔炎.
【药理作用】
本品是丝氨酸/苏氨酸激酶 AKT(AKT1、AKT2 和 AKT3)所有 3 种亚型的抑制剂,并抑制下游 AKT 底物的磷酸化。 肿瘤中 AKT 激活是上游信号通路激活、AKT1 突变、磷酸酶和张力蛋白同源物 (PTEN) 功能丧失以及磷脂酰肌醇 3-激酶 (PIK3CA) 催化亚基 α 突变的结果。
在体外,本品降低了乳腺癌细胞系的生长,包括具有相关 PIK3CA 或 AKT1 突变或 PTEN 改变的乳腺癌细胞系。 在体内, 本品单药使用 以及与氟维司群联合使用可抑制小鼠异种移植模型的肿瘤生长,包括 PIK3CA、AKT1 和 PTEN 改变的雌激素受体阳性乳腺癌模型。
【贮藏】
将本品储存在原瓶中,温度为 20°C 至 25°C(68°F 至 77°F)。 允许温度变化至 15°C 至 30°C。
【有效期】
36个月
【使用方法】
1. 患者选择
根据肿瘤组织中是否存在以下一种或多种基因改变(PIK3CA/AKT1/PTEN),选择接受 TRUQAP 治疗 HR 阳性、HER2 阴性晚期或转移性乳腺癌的患者。
2. 启动 TRUQAP 之前推荐的评估
在开始 TRUQAP 之前以及治疗期间定期评估空腹血糖 (FG) 和糖化血红蛋白 (HbA1C)。
3. 推荐剂量和给药方法
TRUQAP 与氟维司群联用的推荐剂量为每日两次口服 400 mg(间隔约 12 小时),无论是否与食物同服,持续 4 天,然后停药 3 天。 继续 TRUQAP 直至疾病进展或出现不可接受的毒性。
表 1 提供了每周的 TRUQAP 给药方案。
表 1:TRUQAP 每周给药时间表

* 第 5、6 和 7 天无需给药。
整个吞服 TRUQAP 片剂。 吞咽前请勿咀嚼、压碎或劈开药片。 不要服用破损、破裂或其他不完整的药片。
请参阅氟维司群完整处方信息,了解推荐的氟维司群剂量信息。
对于绝经前和围绝经期女性,根据现行临床实践标准给予促黄体激素释放激素 (LHRH) 激动剂。
对于男性,请考虑根据当前的临床实践标准使用 LHRH 激动剂。
【剂量调整】
1. 不良反应相关剂量调整
表2列出了针对不良反应的推荐剂量减少。如果无法耐受第二次剂量减少,则永久终止TRUQAP。
表 2:针对不良反应推荐的 TRUQAP 剂量减少

表3提供了针对不良反应的推荐剂量调整。
表 3:针对不良反应的 TRUQAP 推荐剂量调整
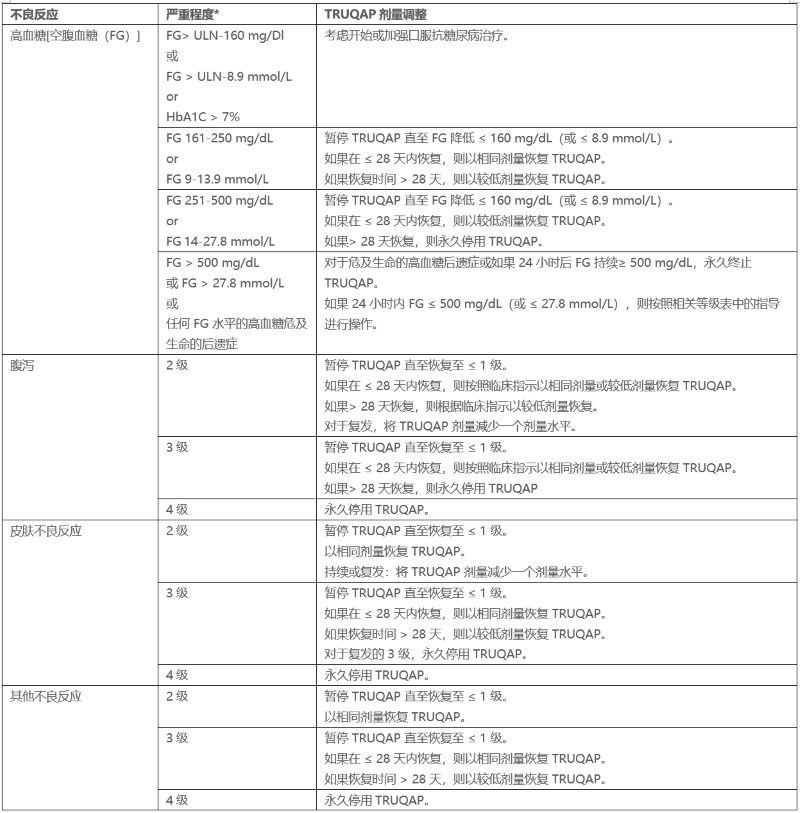
*根据不良事件通用术语标准 (CTCAE) 5.0 版进行严重程度分级。
2. 强效和中度 CYP3A 抑制剂的剂量调整
避免与强效 CYP3A 抑制剂同时使用。 如果无法避免与强效 CYP3A 抑制剂同时使用,请将 TRUQAP 剂量减少至 320 mg,口服,每天两次,持续 4 天,然后停药 3 天。
当与中度 CYP3A 抑制剂同时使用时,将 TRUQAP 剂量减少至 320 mg,口服,每天两次,持续 4 天,然后停药 3 天。
停用强效或中度 CYP3A 抑制剂后,恢复在开始强或中度 CYP3A 抑制剂之前服用的 TRUQAP 剂量(抑制剂的 3 至 5 个半衰期后)。
【延迟或遗漏给药】
如果患者在预定时间 4 小时内错过服药,请指导患者补服错过的剂量。 如果患者错过服药时间超过预定时间 4 小时,请指导患者跳过该剂量并在通常的预定时间服用下一剂。
如果患者服药后呕吐,指导患者不要服用额外的剂量,并在通常的预定时间服用下一剂。
【过量处理】
无相关信息
最常见的不良反应(发生率≥20%),包括实验室异常,为腹泻、皮肤不良反应、随机血糖升高、淋巴细胞减少、血红蛋白降低、空腹血糖升高、恶心、疲劳、白细胞减少、甘油三酯增加、中性粒细胞减少、肌酐升高 、呕吐和口腔炎。
【注意事项】
• 高血糖:在开始前和治疗期间定期评估血糖水平。 根据严重程度暂停、减少剂量或永久停用 TRUQAP。
• 腹泻:TRUQAP 在大多数患者中引起腹泻。 如果服用 TRUQAP 期间出现腹泻,建议患者增加口腔液体,开始止泻治疗,并咨询医疗保健提供者。 根据严重程度暂停、减少剂量或永久停用 TRUQAP。
• 皮肤不良反应:监测皮肤不良反应的症状和体征。 根据严重程度暂停、减少剂量或永久停用 TRUQAP。
• 胚胎-胎儿毒性:TRUQAP 可造成胎儿伤害。 建议患者注意本品对胎儿的潜在风险并使用有效的避孕措施。 有关怀孕和避孕信息,请参阅氟维司群的完整处方信息
【禁忌】
对 TRUQAP 或其任何成分严重过敏。
【特殊人群】
妊娠期:TRUQAP 与氟维司群联合使用。 有关怀孕信息,请参阅氟维司群的完整处方信息。根据动物研究结果及其作用机制,本品给孕妇服用时可能会造成胎儿伤害。
哺乳期:TRUQAP 与氟维司群联合使用。 有关怀孕信息,请参阅氟维司群的完整处方信息。建议女性在使用本品治疗期间不要母乳喂养。
儿童:尚未确定本品对儿童患者的安全性和有效性。
老年患者:在 ≥ 65 岁的患者和年轻患者之间,未观察到 TRUQAP 疗效的总体差异。对≥ 65岁患者与年轻患者的 TRUQAP 安全性分析表明,3 至 5 级不良反应的发生率较高(57% vs 36%)、剂量减少(30% vs 15%)、剂量中断(57% 分别为 23% 与 30%)和永久停药(23% 与 8%)。
肾损伤患者:对于轻度至中度(CLcr30至89 mL/min)肾损伤患者不建议调整剂量[见临床药理学(12.3)。 尚未在严重( CLcr 15 至 29 mL/min)肾损伤患者中研究 TRUQAP。
肝损伤患者:对于轻度肝功能不全(胆红素≤ULN且 AST > ULN 或胆红素 > 1 至 1.5x ULN 和任何 AST)的患者,不建议调整剂量。
【适应症】
本品是一种激酶抑制剂,与氟维司群联合用于治疗患有激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性、伴有一种或多种生物标志物改变PIK3CA/ AKT1/PTEN 改变的局部晚期或转移性乳腺癌成年患者 ,曾在转移性环境中至少一种基于内分泌的治疗方案出现进展,或在完成辅助治疗后 12 个月内复发。
【药物相互作用】
• 强效CYP3A 抑制剂:避免同时使用。 如果无法避免同时使用,则减少 TRUQAP 剂量。
• 中度CYP3A抑制剂:减少TRUQAP剂量。
• 强效和中度CYP3A 诱导剂:避免同时使用。


 在线咨询
在线咨询 400-001-9769
400-001-9769
