【适应症】
本品是程序性死亡受体-1(PD-1)阻断抗体纳武利尤单抗和LAG-3阻断抗体relatlimab的组合,适用于治疗患有不可切除或转移性黑色素瘤的成人和12岁或以上儿童患者。
【推荐剂量】
成人患者和体重至少40公斤的12岁或12岁以上的儿科患者:
每次480 mg nivolumab和160 mg relatlimab,静脉输注,每4周一次,本品静脉持续输注30分钟。
【不良反应】
最常见的不良反应(≥20%)是肌肉骨骼疼痛、疲劳、皮疹、瘙痒和腹泻。
最常见的实验室异常(≥20%)是血红蛋白减少、淋巴细胞减少、AST增加、ALT增加和钠减少。
【使用方法】
本品是纳武利尤单抗和relatlimab的固定剂量组合。
给药前,目视检查药品瓶中的溶液是否有颗粒物和变色。本品是一种透明至乳白色、无色至微黄色的溶液。如果溶液浑浊、变色或含有除少数半透明至白色颗粒外的外来颗粒物,则丢弃小瓶。
制备
• 在制备输液时,使用无菌技术确保无菌,因为产品不含防腐剂。
• 本品可以稀释或未稀释给药,并以下表2规定的最终浓度给药。
• 提取所需体积的本品并转移到静脉注射容器中。本品 与邻苯二甲酸二(2-乙基己基)酯(DEHP)-增塑聚氯乙烯(PVC)、乙酸乙酯(EVA)和聚烯烃(PO)静脉袋兼容。
• 如果在给药前稀释本品:
− 用0.9%氯化钠注射液或5%葡萄糖注射液稀释本品溶液,以制备符合下表2规定的最终浓度和最大输液量参数的输液。
− 然后通过轻轻反转混合稀释溶液。不要摇晃。
• 输液准备后丢弃部分使用的小瓶或空瓶。
表2:按患者组划分的最大输液量和浓度范围

*每组的浓度范围包括12 mg/mL的nivolumab和4mg/mL的relatlimab作为上限,这代表了在不稀释的情况下输注药物的情况。
配制溶液的储存
将制备好的溶液储存在以下任一方式储存:
• 从准备到输液结束,在室温和室内光线下放置不超过8小时。如果在制备后8小时内未使用,则丢弃制备的溶液;
-或者-
在2°C至8°C(36°F至46°F)的温度下进行冷藏,自制备时起,避光时间不超过24小时,包括将输液袋平衡到室温的时间和输液持续时间。如果在制备后24小时内未使用,则丢弃制备的溶液。
不要冷冻。
给药
• 通过含有无菌、非致热、低蛋白结合的在线聚醚砜(PES)、尼龙或聚偏二氟乙烯(PVDF)过滤器(孔径为0.2微米至1.2微米)的静脉管路进行30分钟的输液。
• 输液结束时冲洗静脉管路。
• 不要与其他药物合用同一静脉管路。
【药理作用】
Relatlimab是一种人IgG4单克隆抗体,与LAG-3受体结合,阻断与其配体(包括MHC II)的相互作用,并减少LAG-3途径介导的免疫反应抑制。该途径的拮抗作用促进T细胞增殖和细胞因子分泌。
PD-1配体PD-L1和PD-L2与T细胞上的PD-1受体结合,抑制T细胞增殖和细胞因子的产生。PD-1配体的上调发生在一些肿瘤中,通过这一途径的信号可能有助于抑制肿瘤的主动T细胞免疫监视。纳武利尤单抗(Nivolumab)是一种人IgG4单克隆抗体,与PD-1受体结合,阻断与其配体PD-L1和PD-L2的相互作用,并减少PD-1途径介导的免疫反应抑制,包括抗肿瘤免疫反应。在同基因小鼠肿瘤模型中,阻断PD-1活性导致肿瘤生长减少。
与单独使用任何一种抗体的活性相比,nivolumab(抗PD-1)和relatlimab(抗LAG-3)的组合导致T细胞活化增加。在小鼠同基因肿瘤模型中,LAG-3阻断增强PD-1阻断的抗肿瘤活性,抑制肿瘤生长并促进肿瘤消退。
【贮藏】
在2°C至8°C(36°F至46°F)下冷藏本品,储存在原纸盒中,以避光,直到使用时为止。不要冷冻或摇晃。
【使用方法】
制备和给药
本品是纳武利尤单抗和relatlimab的固定剂量组合。
给药前,目视检查药品瓶中的溶液是否有颗粒物和变色。本品是一种透明至乳白色、无色至微黄色的溶液。如果溶液浑浊、变色或含有除少数半透明至白色颗粒外的外来颗粒物,则丢弃小瓶。
制备
• 在制备输液时,使用无菌技术确保无菌,因为产品不含防腐剂。
• 本品可以稀释或未稀释给药,并以下表2规定的最终浓度给药。
• 提取所需体积的本品并转移到静脉注射容器中。本品 与邻苯二甲酸二(2-乙基己基)酯(DEHP)-增塑聚氯乙烯(PVC)、乙酸乙酯(EVA)和聚烯烃(PO)静脉袋兼容。
• 如果在给药前稀释本品:
− 用0.9%氯化钠注射液或5%葡萄糖注射液稀释本品溶液,以制备符合下表2规定的最终浓度和最大输液量参数的输液。
− 然后通过轻轻反转混合稀释溶液。不要摇晃。
• 输液准备后丢弃部分使用的小瓶或空瓶。
表2:按患者组划分的最大输液量和浓度范围
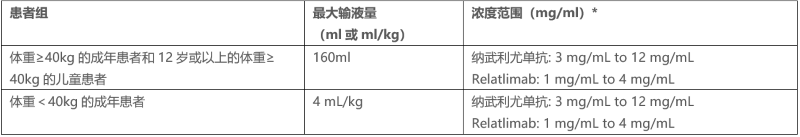
*每组的浓度范围包括12 mg/mL的nivolumab和4mg/mL的relatlimab作为上限,这代表了在不稀释的情况下输注药物的情况。
配制溶液的储存
将制备好的溶液储存在以下任一方式储存:
• 从准备到输液结束,在室温和室内光线下放置不超过8小时。如果在制备后8小时内未使用,则丢弃制备的溶液;
-或者-
在2°C至8°C(36°F至46°F)的温度下进行冷藏,自制备时起,避光时间不超过24小时,包括将输液袋平衡到室温的时间和输液持续时间。如果在制备后24小时内未使用,则丢弃制备的溶液。
不要冷冻。
给药
• 通过含有无菌、非致热、低蛋白结合的在线聚醚砜(PES)、尼龙或聚偏二氟乙烯(PVDF)过滤器(孔径为0.2微米至1.2微米)的静脉管路进行30分钟的输液。
• 输液结束时冲洗静脉管路。
• 不要与其他药物合用同一静脉管路。
【剂量调整】
不建议减少本品的剂量。一般来说,对于严重(3级)免疫介导的不良反应(IMARs),暂停使用本品。对于威胁生命的(4级)IMARs、需要全身免疫抑制治疗的复发性严重(3级)IMARs,或在开始使用类固醇的12周内无法将皮质类固醇剂量减少到每天10 mg或更少的强的松或等效物,永久停用本品。
表1总结了需要不同于这些一般指南管理的不良反应的剂量调整。
表1:不良反应的推荐剂量调整
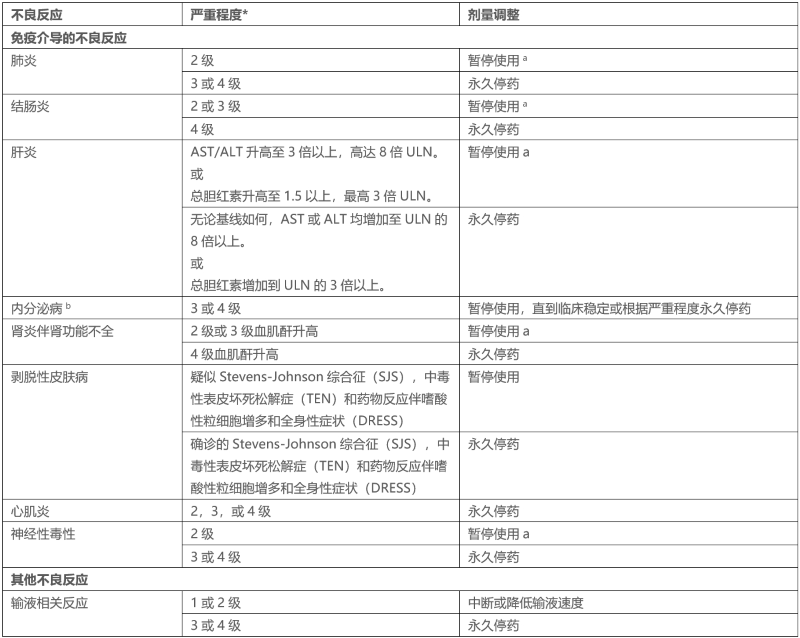
*基于美国国家癌症研究所5.0版《不良事件通用术语标准》。
a糖皮质激素减量后完全或部分缓解(0至1级)的患者恢复使用。如果在最后一次给药后12周内没有完全或部分缓解,或在开始使用类固醇后12周内无法将泼尼松降至每天10mg(或同等剂量)或更少,则永久停止使用。
b根据临床严重程度,考虑2级内分泌疾病暂停使用,直到激素替代治疗症状改善。急性症状消失后恢复使用。
【延迟或遗漏给药】
无相关信息
【过量处理】
无相关信息
【不良反应】
最常见的不良反应(≥20%)是肌肉骨骼疼痛、疲劳、皮疹、瘙痒和腹泻。
最常见的实验室异常(≥20%)是血红蛋白减少、淋巴细胞减少、AST增加、ALT增加和钠减少。
【注意事项】
• 免疫介导的不良反应:
o 免疫介导的不良反应可能是严重或致命的,可发生在任何器官系统或组织中,包括以下几种:免疫介导性肺炎、免疫介导性结肠炎、免疫介导性肝炎、免疫介导性内分泌疾病、免疫介导性皮肤病不良反应、免疫介导性的肾炎肾功能障碍和免疫介导性心肌炎。
o 监督早期识别和管理。在基线和治疗期间定期评估肝酶、肌酸酐和甲状腺功能。
o 根据反应的严重程度和类型暂停或永久停药。
• 输液相关反应:根据反应的严重程度中断、减慢输液速度或永久停药。
• 异基因造血干细胞移植的并发症:在接受PD-1/PD-L1阻断抗体治疗之前或之后接受异基因造血细胞移植的患者可能会出现致命和其他严重并发症。
• 胚胎-胎儿毒性:可能对胎儿造成伤害。建议育龄期女性注意对胎儿的潜在风险,并采取有效的避孕措施。
【禁忌】
无
【特殊人群】
妊娠期:根据动物研究结果及其作用机制,本品给孕妇服用时可能会造成胎儿伤害。
哺乳期:建议女性在使用本品治疗期间以及最终剂量后至少5个月内不要母乳喂养。
儿童:本品治疗不可切除或转移性黑色素瘤的安全性和有效性已在12岁或以上且体重至少40kg的儿童患者中得到证实。
本品在12岁或12岁以上且体重小于40kg的儿童患者和12岁以下的儿童患者中的安全性和有效性尚未确定。
老年患者: 没有观察到老年患者和年轻患者在安全性或有效性方面的总体差异。
【适应症】
本品是程序性死亡受体-1(PD-1)阻断抗体纳武利尤单抗和LAG-3阻断抗体relatlimab的组合,适用于治疗患有不可切除或转移性黑色素瘤的成人和12岁或以上儿童患者。
【药物相互作用】
无相关信息




 在线咨询
在线咨询 400-001-9769
400-001-9769
