【适应症】
本品是一种靶向gp100肽HLA的CD3 双特异性T细胞接合剂,适用于治疗HLA-a*02:01阳性的患有不可切除或转移性葡萄膜黑色素瘤的成年患者。
【推荐剂量】
推荐剂量:第1天静脉注射20微克,第8天静脉注射30微克,第15天静脉注射68微克,此后每周静脉注射一次68微克。
•稀释并通过静脉输注给药15-20分钟
•有关静脉输注稀释溶液的制备和给药说明,请参阅完整的处方信息。
•根据个体安全性和耐受性,可能需要中断剂量或永久停药。
【不良反应】
最常见的不良反应(发生率≥30%)是细胞因子释放综合征、皮疹、发热、瘙痒、疲劳、恶心、发冷、腹痛、水肿、低血压、皮肤干燥、头痛和呕吐。
最常见的实验室异常(发生率≤50%)是淋巴细胞计数下降、肌酐升高、葡萄糖升高、天冬氨酸转氨酶升高,丙氨酸氨基转移酶增加,血红蛋白减少,磷酸盐减少。
【药理作用】
Tebentafusp-tebn 是一种双特异性 gp100 肽-HLA-A*02:01 定向 T 细胞受体 CD3 T 细胞接合剂。 TCR 臂与葡萄膜黑色素瘤细胞表面的人类白细胞抗原 A*02:01 (HLA A*02:01) 呈递的 gp100 肽结合。 在体外,tebentafusp-tebn 与 HLA-A*02:01 阳性葡萄膜黑色素瘤细胞结合,并激活多克隆 T 细胞释放炎症细胞因子和溶细胞蛋白,从而导致葡萄膜黑色素瘤肿瘤细胞的直接裂解。
【贮藏】
将 KIMMTRAK 小瓶存放在原包装盒中,在 2°C 至 8°C的温度下冷藏,并在使用前避光保存。 不要冻结。 不要摇晃。
【有效期】
18个月
【使用方法】
1. 患者选择
根据全血样本的阳性 HLA-A*02:01 基因分型测试,选择接受 KIMMTRAK 治疗不可切除或转移性葡萄膜黑色素瘤的患者。
2. 推荐剂量
KIMMTRAK 静脉注射的推荐剂量为:
• 第一天 20 mcg
• 第 8 天 30 mcg
• 第 15 天 68 mcg
• 此后每周一次 68 mcg
治疗患者直至出现不可接受的毒性或疾病进展。
在适当的医疗环境中通过静脉输注 15-20 分钟进行 KIMMTRAK 的前三次输注。 在输注期间以及输注完成后至少 16 小时内监测患者。
如果患者在第三次输注期间或之后没有出现 2 级或更严重的低血压(需要医疗干预),请在适当的门诊护理环境中进行后续剂量,并在每次输注后监测患者至少 30 分钟。
3. 制备和给药
制备
• 准备最终的KIMMTRAK 输注剂量需要进行两步稀释过程。
• 使用无菌技术稀释和制备静脉输液。
• 在溶液和容器允许的情况下,在给药前目视检查肠外药品和输液袋是否有颗粒物质和变色。
第1步:输液袋的准备
为了防止 tebentafusp-tebn 吸附到输液袋和药物输液系统的其他组件上,请按如下方式在 0.9% 氯化钠注射液、USP 溶液中制备白蛋白(人):
a. 使用刻度为 2 位小数的 1 mL 注射器和无菌针头,将计算体积的白蛋白(人)抽入注射器中(参见下表 2),并添加到由聚烯烃 (PO)[(例如聚乙烯 (PE) 和聚丙烯 (PP)] 或聚氯乙烯 (PVC)]制成的 100 mL 0.9% 氯化钠注射液输液袋中 ,以使最终白蛋白(人)浓度达到 250 mcg/mL。
表 2:白蛋白(人)浓度和体积示例

b. 轻轻地通过完成以下步骤以使制备的溶液均匀:
i 翻转输液袋,使输液袋倒置,入口位于顶部。 然后轻敲端口管的侧面,以确保任何残留溶液释放到溶液中。
ii 通过从倒置位置轻轻地纵向旋转袋子 360 度至少 5 次来混合制备的溶液。 不要摇晃输液袋。
iii 再重复 (i) 和 (ii) 3 次。
第 2 步 - KIMMTRAK 输注溶液的制备
*白蛋白(人); 根据当地情况使用浓度。 示例包括但不限于以下浓度:5%、20% 或 25%
a. 请勿摇动 KIMMTRAK 小瓶。
b. 使用刻度为 2 位小数的 1 mL 注射器和无菌针头,按照所需剂量(如下表 3 所示)抽取所需体积的 KIMMTRAK 100 mcg/0.5 mL,并添加到已准备好的含有 0.9% 氯化钠注射液100 mL和白蛋白(人)输液袋中。
c. 根据当地要求丢弃含有未使用的 KIMMTRAK 部分的单剂量小瓶。 不要从小瓶中制备多于一剂的剂量。
表 3:添加到输液袋中所需的 KIMMTRAK 体积
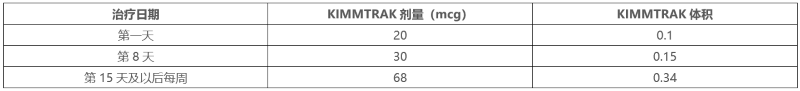
d. 按照步骤 1b 中概述的相同程序混合输液袋。
给药
• 立即通过专用静脉管路历时15-20 分钟内通过静脉输注施用稀释溶液。 应使用无菌、无热原、低蛋白结合的 0.2 微米内联过滤输液器。 输注 KIMMTRAK 输液袋中的全部内容物。
• 配制好的输液袋应在配制后4 小时内使用,包括输注期间。 在 4 小时窗口期间,KIMMTRAK 输液袋应保持在室温。
• 如果不立即使用,请将 KIMMTRAK 输注袋存放在 2°C 至 8°C(36°F 至 46°F)的冰箱中,并在准备后 24 小时内输注,其中包括冰箱中的存放时间 、输液袋平衡至室温的时间以及输液持续时间。
• 从冰箱中取出后,请勿再次冷藏 KIMMTRAK 输液袋。 不要冻结。 超过建议储存时间后丢弃未使用的 KIMMTRAK 溶液。
• 不要将KIMMTRAK 与其他药物混合或通过同一静脉输液管路施用其他药物。
• KIMMTRAK 输注完成后,用足量的无菌 0.9% 氯化钠注射液(USP)冲洗输注管,以确保注射输注袋中的全部内容物。
【剂量调整】
不建议减少 KIMMTRAK 的剂量。 表 1 总结了针对不良反应的 KIMMTRAK 剂量调整。
表 1:针对不良反应的剂量调整
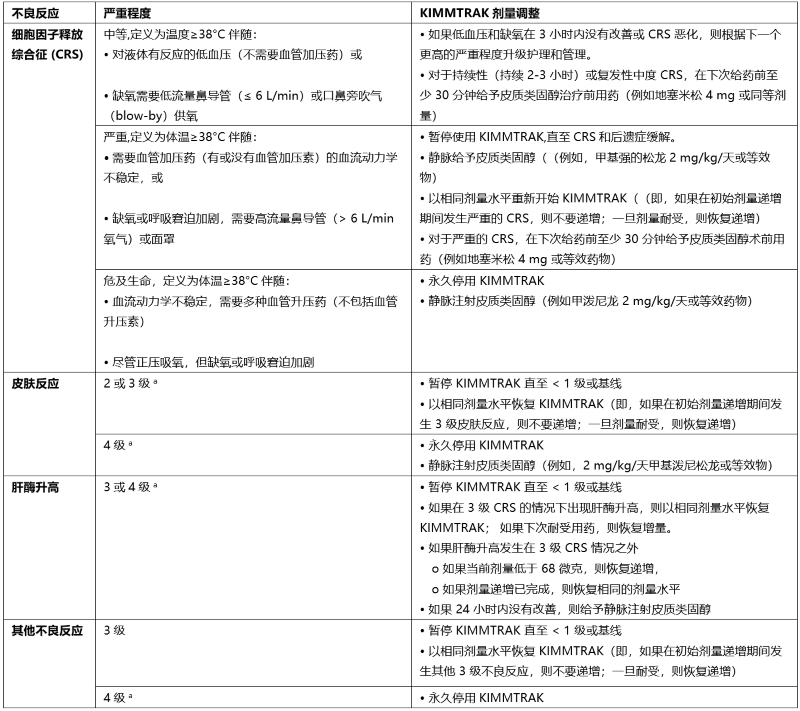
a 基于美国国家癌症研究所不良事件通用术语标准 (CTCAE) 4.03 版 (NCI CTCAEv4.03)
【延迟或遗漏给药】
无相关信息
【过量处理】
无相关信息
【不良反应】
最常见的不良反应(发生率≥30%)是细胞因子释放综合征、皮疹、发热、瘙痒、疲劳、恶心、发冷、腹痛、水肿、低血压、皮肤干燥、头痛和呕吐。
最常见的实验室异常(发生率≤50%)是淋巴细胞计数下降、肌酐升高、葡萄糖升高、天冬氨酸转氨酶升高,丙氨酸氨基转移酶增加,血红蛋白减少,磷酸盐减少。
【注意事项】
• 皮肤反应:KIMMTRAK治疗的患者出现皮疹、瘙痒和皮肤水肿。如果出现皮肤反应,根据症状的持续性和严重性。
• 肝酶升高:接受KIMMTRAK治疗的患者肝酶升高。监测ALT、AST和总胆红素。
• 胚胎-胎儿毒性:可能对胎儿造成伤害。建议有生育潜力的患者注意对胎儿的潜在风险,并采取有效的避孕措施。
【适应症】
本品是一种靶向gp100肽HLA的CD3 双特异性T细胞接合剂,适用于治疗HLA-a*02:01阳性的患有不可切除或转移性葡萄膜黑色素瘤的成年患者。
无相关信息


 在线咨询
在线咨询 400-001-9769
400-001-9769
