【适应症】
本品用于治疗成人真性红细胞增多症。
【推荐剂量】
-未使用羟基脲(Hydroxyurea)的患者:
起始剂量为100mcg,皮下注射,每两周一次。每两周增加剂量50mcg(最多500mcg),直至血液学参数稳定(血细胞比容低于45%,血小板低于400 x 109/L,白细胞低于10 x 109/L)。
-从羟基脲过渡的患者:
起始剂量为50 mcg,皮下注射,每两周一次。在第3-12周期间逐渐减少羟基脲用量,每两周将剂量减少20-40%。每两周将本品的剂量增加50 mcg(最多500 mcg),直至血液学参数稳定(血细胞比容低于45%,血小板低于400 x 109/L,白细胞低于10 x 109/L)。
在第13周停用羟基脲。
维持本品两周一次给药,直到血液学稳定达到至少1年。在稳定剂量的Besremi达到血液学稳定性至少1年后,给药间隔时间可延长至每4周一次。
【不良反应】
最常见的不良反应(>40%):流感样疾病、关节痛、疲劳、瘙痒、鼻咽炎和肌肉骨骼疼痛。
【药理作用】
干扰素α属于I型干扰素类,通过与干扰素α受体(IFNAR)的跨膜受体结合,在骨髓真性红细胞增多症中表现出细胞效应。与IFNAR的结合通过激酶的激活启动下游信号级联,特别是Janus激酶1 (JAK1)和酪氨酸激酶2 (TYK2)以及转录激活因子(STAT)蛋白。STAT蛋白的核易位控制着不同的基因表达程序,并表现出多种细胞效应。干扰素α治疗真性红细胞增多症的作用尚未完全阐明。
【贮藏】
-在2℃至8℃的冰箱中保存。
-请勿冷冻预充式注射器。
-请勿使用已冷冻或置于阳光直射下的预充式注射器。
-将本品预充式注射器、针头和所有药物放在儿童拿不到的地方。
【有效期】
24个月
【使用方法】
-本品仅用于皮下注射。
-本品仅供一次性使用。请勿重复使用预充式注射器或针头。
-将本品注射到大腿上部或胃下部皮肤正下方的区域。请勿将本品注射到身体的任何其他部位。
-检查预充式注射器中的药液。液体应为清澈无色至微黄色,且不应有颗粒。如果液体浑浊、变色或含有颗粒,请勿使用预充式注射器。
-请勿向发炎、发红、擦伤、感染或有疤痕的皮肤注射。每次注射,需要轮换注射部位。
-对于有生殖潜力的女性,建议在接受本品治疗前进行妊娠检测。
-密切监测患者,尤其是在滴定阶段(滴定阶段:通过逐渐调整用药剂量,以获得最佳用药剂量)。定期进行全血细胞计数(CBC),在滴定阶段每2周进行一次,在维持阶段每3-6个月进行一次(在确定患者的最佳剂量后)。如果有临床指征,应更频繁地监测CBC。在滴定阶段,可能有必要进行静脉切开术作为使高粘血症正常化的抢救治疗。
【推荐剂量】
-未使用羟基脲(Hydroxyurea)的患者:
起始剂量为100mcg,皮下注射,每两周一次。每两周增加剂量50mcg(最多500mcg),直至血液学参数稳定(血细胞比容低于45%,血小板低于400 x 109/L,白细胞低于10 x 109/L)。
-从羟基脲过渡的患者:
起始剂量为50 mcg,皮下注射,每两周一次。在第3-12周期间逐渐减少羟基脲用量,每两周将剂量减少20-40%。每两周将本品的剂量增加50 mcg(最多500 mcg),直至血液学参数稳定(血细胞比容低于45%,血小板低于400 x 109/L,白细胞低于10 x 109/L)。
在第13周停用羟基脲。
维持本品两周一次给药,直到血液学稳定达到至少1年。在稳定剂量的Besremi达到血液学稳定性至少1年后,给药间隔时间可延长至每4周一次。
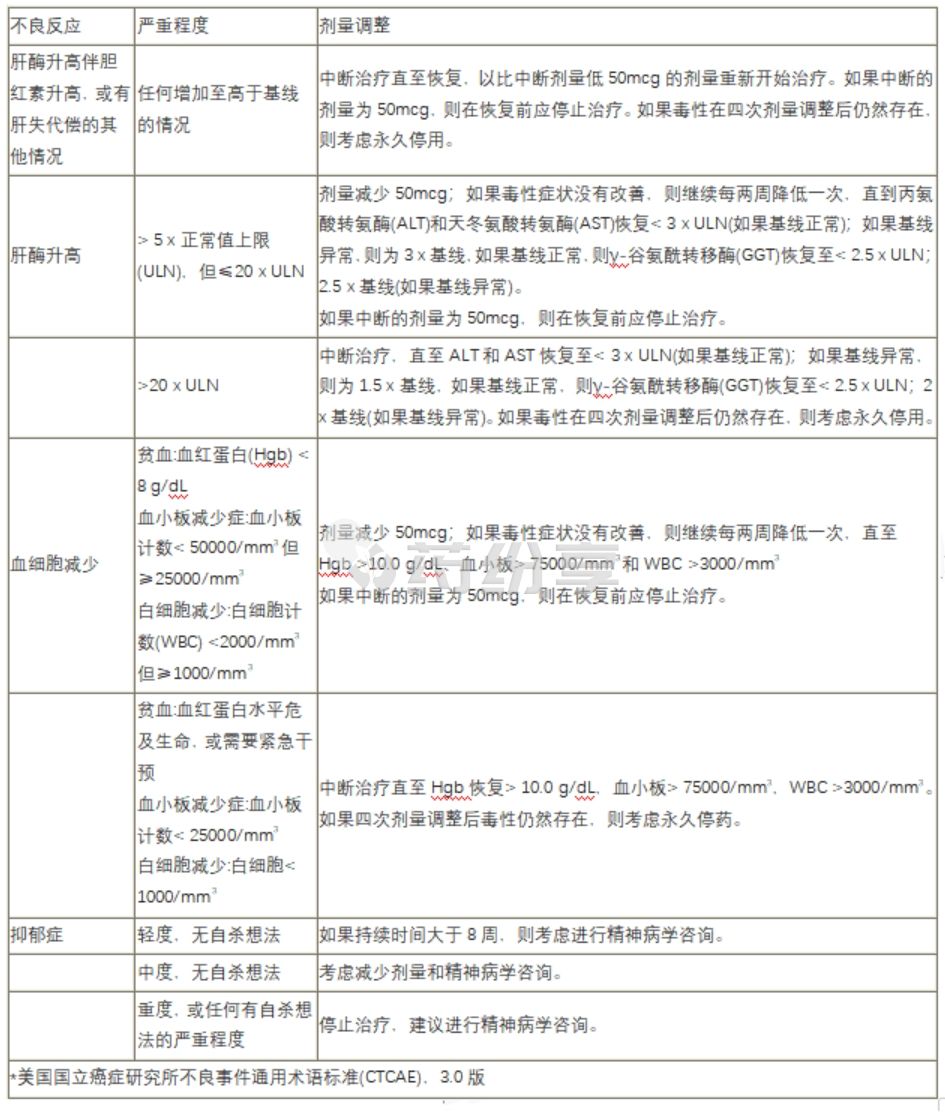
【剂量调整】
在滴定阶段和剂量调整阶段,每2周监测一次CBC。可能有必要进行静脉切开术,作为使高粘血症正常化的抢救治疗。
如果发生给药中断,按先前达到的水平恢复给药。如果出现药物相关毒性,按照下表(表1)将剂量降低至下一个较低水平或中断给药。如果在剂量调整后降低剂量时疗效不足,则在恢复至1级毒性后,应考虑尝试增加剂量至下一个更高剂量水平。
【服用过量处理】
过量使用本品可能导致流感样症状或其他不良反应。本品过量没有解药。如果用药过量,应经常监测体征和症状,以了解不良反应。
【漏服处理】
无
【不良反应】
最常见的不良反应(>40%):流感样疾病、关节痛、疲劳、瘙痒、鼻咽炎和肌肉骨骼疼痛。
【注意事项】
-严重疾病风险严重疾病风险:
干扰素α产品可能导致或加重致命或危及生命的神经精神、自身免疫、缺血和感染性疾病。应通过定期临床和实验室评估密切监测患者。对于这些疾病的体征或症状持续严重或恶化的患者,应停止治疗。在许多病例中,这些疾病在停止治疗后会消退。
-抑郁症与自杀:
接受干扰素α产品(包括本品)治疗的患者出现了危及生命或致命的神经精神反应。这些反应可能发生在有或无既往精神疾病的患者中。在临床开发项目期间,3%接受本品治疗的患者出现了严重的神经精神反应。在本品临床开发项目的178例患者中,发生抑郁、抑郁症状、抑郁情绪、精神萎靡的有17例。在这17例病例中,3.4%的患者在暂时中断药物治疗后痊愈,2.8%的患者停止了本品治疗。
使用其他干扰素α产品时,还观察到了其他中枢神经系统效应,包括自杀意念、自杀未遂、攻击性、双相情感障碍、躁狂症和精神错乱。有严重精神疾病史,特别是严重抑郁症、自杀意念或自杀企图的患者禁用本品。
密切监测患者是否有任何精神疾病症状,如果出现此类症状,考虑进行精神病学咨询和治疗。如果精神症状恶化,建议停止本品治疗。
-内分泌毒性:
接受干扰素α产品(包括本品)治疗的患者出现了内分泌毒性。这些毒性可能包括恶化的甲状腺功能减退和甲状腺功能亢进。接受干扰素α-2b产品治疗的患者中,曾有发生自身免疫性甲状腺炎和高血糖症(包括新发1型糖尿病)的报告。本品研发项目中发生甲状腺功能亢进8例(4.5%),甲状腺功能减退7例(3.9%),自身免疫性甲状腺炎/甲状腺炎5例(2.8%)。
对于与自身免疫性疾病相关的活动性严重或未治疗的内分泌紊乱患者,请勿使用本品。评估在本品治疗期间出现提示甲状腺疾病症状的患者的甲状腺功能。对于在本品治疗期间出现无法充分控制的内分泌紊乱的患者,停用本品。
-心血管毒性:
接受干扰素α产品(包括本品)治疗的患者出现了心血管毒性。毒性可能包括心肌病、心肌梗死、房颤和冠状动脉缺血。在本品治疗期间,应密切监测有心血管疾病史的患者的心血管毒性。对于患有严重或不稳定的心血管疾病(例如,无法控制的高血压、充血性心力衰竭(≥NYHA 2级)、严重心律失常、显著的冠状动脉狭窄、不稳定型心绞痛)或近期中风或心肌梗死的患者,避免使用本品。
-外周血细胞计数降低:
接受干扰素α产品(包括本品)治疗的患者出现了外周血细胞计数下降。这些毒性可能包括血小板减少症(增加出血风险)、贫血和白细胞减少症(增加感染风险)。2%接受本品治疗的患者出现3级(血小板计数< 50000-25000/mm3)或更高的血小板减少症。1%接受本品治疗的患者出现3级(Hgb < 8 g/dL)或以上贫血。2%接受本品治疗的患者出现3级(WBC计数< 2000-1000/mm3)或更高的白细胞减少症。48%接受本品治疗的患者发生感染,而8%接受本品治疗的患者发生严重感染。在基线、滴定期间和维持期每3-6个月监测一次全血计数。监测患者是否有感染或出血的体征和症状。
-超敏反应:
接受干扰素α产品(包括本品)治疗的患者发生了超敏反应。对干扰素产品或本品中的任何非活性成分有超敏反应的患者禁用本品。毒性可能包括严重的急性超敏反应(如荨麻疹、血管性水肿、支气管收缩、过敏反应)。如果发生此类反应,立即停用本品并进行适当的药物治疗。短暂性皮疹可能不需要中断治疗。
-胰腺炎:
接受干扰素α产品(包括本品)治疗的患者发生了胰腺炎。2.2%接受本品治疗的患者报告有胰腺炎。症状可能包括恶心、呕吐、上腹痛、腹胀和发热。患者可能出现脂肪酶、淀粉酶、白细胞计数升高或肾/肝功能改变。对可能患有胰腺炎的患者中断本品治疗,并立即进行评估。对于确诊为胰腺炎的患者,考虑停用本品。
-结肠炎:
接受干扰素α产品治疗的患者发生了致死性和严重的溃疡性或出血性/缺血性结肠炎,有些病例早在治疗开始后12周就发生了。症状可能包括腹痛、血性腹泻和发烧。对于出现这些体征或症状的患者,停用本品。结肠炎可能在停止治疗的1至3周内消退。
-肺毒性:
接受干扰素α产品(包括本品)治疗的患者发生了肺毒性。肺毒性可表现为呼吸困难、肺浸润、肺炎、闭塞性细支气管炎、间质性肺炎、肺动脉高压和结节病。某些事件已导致呼吸衰竭或死亡。对于出现肺浸润或肺功能损害的患者,停用本品。
-眼科毒性:
接受干扰素α产品(包括本品)治疗的患者出现了眼科毒性。这些毒性可能包括严重的眼部疾病,如视网膜病变、视网膜出血、视网膜渗出物、视网膜脱离和视网膜动静脉阻塞,可能导致失明。在本品治疗期间,23%的患者被确定为眼部疾病。发生概率≥5%的眼科疾病包括白内障(6%)和干眼症(5%)。建议患者在本品治疗前和治疗期间进行眼部检查,尤其是患有糖尿病或高血压等视网膜病变相关疾病的患者。及时评估眼部症状。对于出现新的或恶化的眼部疾病的患者,停用本品。
-血脂过多:
使用干扰素α产品(包括本品)治疗的患者出现了高脂血症。3%接受本品治疗的患者出现高脂血症、高甘油三酯血症或血脂异常。甘油三酯升高可能导致胰腺炎。在本品治疗前和治疗期间间歇性监测血清甘油三酯,并在升高时进行管理。考虑在甘油三酯持续显著升高的患者中停用本品。
-肝中毒:
接受干扰素α产品(包括本品)治疗的患者发生了肝毒性。这些毒性可能包括血清ALT、AST、GGT和胆红素升高。中度(Child-Pugh B)或重度(Child-Pugh C)肝功能损害患者禁用本品。
在接受本品治疗的患者中,观察到血清ALT升高≥3倍正常值上限(ULN),AST升高≥3倍ULN,GGT升高≥3倍ULN,胆红素升高> 2倍ULN。
在本品临床开发项目中,36例患者(20%)出现肝酶升高,其中33例患者的ULN升高1.25-5倍。肝酶升高消退后,患者能够恢复本品。在长期本品治疗后的患者中也有肝酶升高的报告。
在基线和Besremi治疗期间监测肝酶和肝功能。对于AST/ALT/GGT升高,将本品剂量减少50 mcg,然后每周监测AST/ALT/GGT,直至值恢复至基线或1级(如果基线正常,ALT和AST < 3 x ULN;如果基线异常,则为1.5 -3 x基线,如果基线正常,则为GGT < 2.5 x ULN;2 -2.5 x基线(如果基线异常)。如果毒性没有改善,则每两周一次继续降低本品剂量,直至恢复至1级。如果AST/ALT/GGT > 20 x ULN,则保持不变,如果四次剂量减少后肝酶水平持续升高,则考虑永久停药。对于在治疗期间出现肝功能代偿不全迹象(表现为黄疸、腹水、肝性脑病、肝肾综合征或静脉曲张出血)的患者,停用本品。
-肾毒性:
接受干扰素α产品(包括本品)治疗的患者发生了肾毒性。在本品治疗期间,据报告< 1%的患者出现肾功能损害,< 1%的患者出现中毒性肾病。在基线和治疗期间监测血清肌酸酐。eGFR <30 mL/min的患者避免使用本品。如果治疗期间出现严重肾功能损害,则停用本品。
-牙齿和牙周毒性:
接受干扰素α产品(包括本品)治疗的患者可能出现牙齿和牙周毒性。这些毒性可能包括可能导致牙齿脱落的牙齿和牙周疾病。此外,在长期本品治疗期间,口干可能会对牙齿和口腔粘膜产生损害作用。患者应保持良好的口腔卫生,并定期进行牙科检查。
-皮肤毒性:
接受干扰素α产品(包括本品)治疗的患者发生了皮肤毒性。这些毒性包括皮疹、瘙痒、脱发、红斑、银屑病、干皮病、痤疮样皮炎、角化过度和多汗症。如果出现具有临床意义的皮肤毒性,则考虑停用本品。
-驾驶和操作机械:
本品可能会影响驾驶和使用机器的能力。在患者了解本品如何影响其能力之前,不应驾驶或使用重型机械。在本品治疗期间出现头晕、嗜睡或幻觉的患者应避免驾驶或使用机器。
-胚胎毒性:
根据作用机制,对孕妇使用本品可对胎儿造成伤害。建议有生殖潜力的女性在接受本品治疗前进行妊娠检测。建议有生殖潜力的女性在接受本品治疗期间和末次给药后至少8周内使用有效的避孕方法。
【禁忌】
-存在或有严重精神疾病史,特别是严重抑郁症、自杀意念或自杀企图。
-对干扰素(包括干扰素α-2b)或本品的任何非活性成分过敏。
-中度(Child-Pugh B)或重度(Child-Pugh C)肝功能损害。
-活动性严重或未治疗的自身免疫性疾病的病史或存在情况。
-免疫抑制的移植受者。
【特殊人群】
-妊娠:
孕妇使用本品的可用人类数据不足以确定重大出生缺陷、流产或不良母体或胎儿结局的药物相关风险。
-哺乳期:
没有关于人或动物乳汁中存在本品、对母乳喂养的儿童的影响或对乳汁产生的影响的数据。由于本品母乳喂养的儿童可能出现严重的不良反应,建议妇女在治疗期间和最后一次给药后8周内不要进行母乳喂养。
-具有生殖潜力的男性和女性:
当对孕妇给药时,本品可能会对胚胎造成损伤。建议有生殖潜力的女性在接受本品治疗前进行妊娠测试。
1)避孕
女性:建议有生殖潜力的女性患者在接受本品治疗期间以及最后一次给药后至少8周内使用有效避孕方法。
2)不孕不育
女性:根据其作用机制,本品可导致月经周期中断。
-儿科使用:
本品在儿科患者中的安全性和有效性尚未确定。
-老年使用:
本品的临床研究未包括足够数量的65岁及以上的受试者,无法确定他们的反应是否与较年轻的受试者不同。
-肾损伤患者:
肾小球滤过率(eGFR) ≥30mL/min的患者无需调整剂量。eGFR <30mL/min的患者避免使用本品。
-肝损伤患者:
肝功能损害(Child-Pugh B或C)患者禁用本品。在接受本品治疗的患者中观察到肝酶水平升高。当肝酶水平的升高是进行性和持续性的时,应减少本品的剂量。如果减少了剂量后,肝酶的升高仍是进行性的且具有临床意义,或如果有肝功能损害的证据(Child-Pugh B或C),则停用本品。
【适应症】
本品用于治疗成人真性红细胞增多症。
【药物相互作用】
-细胞色素P450代谢的药物:
某些促炎细胞因子(包括干扰素)可抑制CYP450酶,从而增加某些CYP底物的暴露量。因此,应监测正在接受CYP450底物且治疗指数较窄的合用药物治疗的本品患者,以告知需要调整这些合用药物的剂量。
-骨髓抑制药:
本品与骨髓抑制药合用可产生相加性骨髓抑制。避免使用并监测联合用药患者的过度骨髓抑制效应。
-麻醉剂、安眠药或镇静剂:
本品与麻醉剂、催眠药或镇静剂合用会产生附加的神经精神副作用。避免使用并监测联合用药患者的CNS毒性过大的影响。


 在线咨询
在线咨询 400-001-9769
400-001-9769
