【适应症】
本品是一种基于腺相关病毒载体的基因疗法,适用于治疗中度至重度B型血友病(先天性因子IX缺乏症)成人患者,该患者:
-目前正在使用因子IX预防性治疗,或
-目前或曾经发生危及生命的出血,或
-反复发生严重的自发性出血事件,以及,
-经过FDA批准的检测测试确定没有针对Rh74var(AAVRh74var)腺相关病毒血清型衣壳的中和抗体。
【推荐剂量】
推荐剂量为单次静脉输注5 × 1011个载体基因组/kg体重(vg/kg)。
为了确定患者所需的剂量,需要以下计算步骤:
1) 计算患者剂量重量:
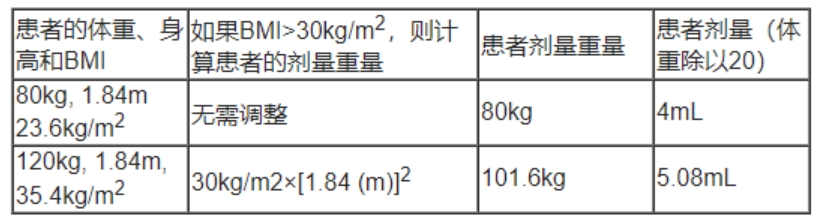
基于患者的体重指数(BMI)(kg/m2)计算剂量重量,见下表:
2)计算患者剂量的体积:
剂量重量(千克)除以20 =剂量(毫升),剂量体积计算示例:
【不良反应】
最常见的不良反应(≥5%)是转氨酶升高。
【药理作用】
本品是一种基因疗法,旨在将编码高活性FIX变体(FIX-R338L,hFIX Padua)的因子IX基因的功能副本引入转导细胞。AAV RH 74 var衣壳能够转导肝细胞,即因子IX合成的天然位点。本品单次静脉输注导致B型血友病患者细胞转导和循环因子IX活性增加。
【贮藏】
-在−100 °C~−60 °C温度下冷冻运输。
-在 -90°C ~-60°C温度下保存。避光保存。
-放置于原包装盒内且药瓶直立保存
-冷冻小瓶将在室温下解冻长达1小时(最高30 °C)
-药瓶可以轻轻旋转,但不能摇晃或倒置。
-从冷冻储存中取出小瓶到开始制备之间的室温总时间不应超过3小时。
-一旦解冻,药品不应重新冷冻,但可在2 °C至8 °C的内纸箱中冷藏储存长达24小时。
-在含0.25%人血清白蛋白(HSA)的0.9%氯化钠中稀释后,已证明在2 °C至30 °C下可保持24小时的化学和物理使用中稳定性。
【有效期】
36个月
【使用方法】
-仅用于一次性单剂量静脉输注,持续输注60分钟。
-不要静脉推注或快速滴注给药。
-本品治疗前,对患者进行AAVRh74var中和抗体进行检测,AAVRh74var抗体检测阳性的患者,禁止使用本品。
-在输注前进行因子IX(FIX)抑制剂检测。请勿将本品用于检测阳性(≥0.6 Bethesda单位[BU])或有因子IX抑制剂既往史的患者。
-在输注前进行HIV检测。如果有HIV-1或HIV-2感染的血清学证据,则不要将本品用于CD 4+细胞计数<200 mm 3或病毒载量≥20拷贝/mL的患者。
-请勿将本品用于对因子IX替代产品过敏的患者。
-本品使用前,对患者进行肝功能检查(丙氨酸转氨酶[ALT]、天冬氨酸转氨酶[AST]、碱性磷酸酶[ALP]、胆红素、白蛋白)。有肝脏相关凝血功能障碍、低白蛋白血症、持续性黄疸或肝硬化、门静脉高压、脾肿大、肝性脑病、肝纤维化或活动性病毒性肝炎的患者请勿使用本品。
-本品需使用含0.25% HSA的0.9%氯化钠溶液稀释后给药,稀释后最终药液体积为200ml
-给药前,目视检查解冻产品中的颗粒物质。不要使用含有可见微粒的小瓶。小瓶中解冻的悬浮液应呈现透明至微乳白色、无色至微棕色。
-不要将稀释的本品悬浮液与任何其他药物一起注入同一静脉输液管。
【推荐剂量】
推荐剂量为单次静脉输注5 × 1011个载体基因组/kg体重(vg/kg)。
为了确定患者所需的剂量,需要以下计算步骤:
1) 计算患者剂量重量:
基于患者的体重指数(BMI)(kg/m2)计算剂量重量,见下表:
2)计算患者剂量的体积:
剂量重量(千克)除以20 =剂量(毫升),剂量体积计算示例:
【剂量调整】
无
【服用过量处理】
无
【漏服处理】
无
【不良反应】
最常见的不良反应(≥5%)是转氨酶升高。
【注意事项】
-肝毒性:
本品给药后至少持续4个月,每周1次或2次,监测患者的转氨酶和因子 IX 活性水平,以降低潜在肝毒性的风险。如果出现转氨酶升高或因子 IX 活性下降,考虑使用皮质类固醇治疗。
-输注反应:
在给药期间和输液结束后至少 3 小时内进行监测。如果患者出现症状,请降低输液速度或停止给药。输注反应消退后,以较慢的速度重新开始输注。
-恶性肿瘤:
监测有肝细胞癌危险因素的患者(例如乙型或丙型肝炎、非酒精性脂肪性肝病、慢性饮酒、非酒精性脂肪性肝炎、高龄),定期进行肝脏超声检查(例如,每年一次)和给药后5年内,监测患者的甲胎蛋白。使用本品治疗后,如果发生恶性肿瘤,请致电 1-800-438-1985 联系辉瑞公司。
-监测实验室化验报告:
监测因子 IX 活性和因子IX抑制。
【禁忌】
无相关信息
【特殊人群】
-HIV感染患者:
关于本品用于HIV感染患者的安全性和有效性的信息有限。
-因子IX抑制者:
本品在既往或活动性因子IX抑制者中的安全性和有效性尚未确定。
-妊娠:
本品不适合女性用药。尚无孕妇使用本品的数据。没有对本品进行动物生殖研究。
-哺乳期:
没有关于母乳中是否存在本品、对母乳喂养婴儿的影响以及对泌乳量的影响的信息。
-具有生殖潜力的女性和男性:
尚未进行动物研究或临床研究来评估本品对人类生育能力的潜在影响。男性患者应在接受本品治疗后的6个月内避免捐献精子、禁欲或使用有效避孕套。
-儿童:
尚未确定本品在儿科患者中的安全性和有效性。尚未进行任何相互作用研究
-老年人:
该临床研究没有任何年龄≥65岁的患者。本品在老年患者中的安全性和有效性尚未确定。
-肝损伤:
尚未在肝损伤患者中进行研究。
-肾功能损伤:
尚未在肾功能损伤患者中进行研究。
【适应症】
本品是一种基于腺相关病毒载体的基因疗法,适用于治疗中度至重度B型血友病(先天性因子IX缺乏症)成人患者,该患者:
-目前正在使用因子IX预防性治疗,或
-目前或曾经发生危及生命的出血,或
-反复发生严重的自发性出血事件,以及,
-经过FDA批准的检测测试确定没有针对Rh74var(AAVRh74var)腺相关病毒血清型衣壳的中和抗体。
【药物相互作用】
尚未进行任何相互作用研究。




 在线咨询
在线咨询 400-001-9769
400-001-9769
