【适应症】
本品是一种基于腺相关病毒(AAV rh74)的基因疗法,用于治疗4至5岁儿童患者的已确定携带DMD基因突变的杜氏肌营养不良症(DMD)。
【推荐剂量】
推荐剂量为1.33 × 1014个载体基因组/公斤体重,或10ml/公斤体重
本品剂量(ml)=患者体重(公斤)x 10
倍增因子10代表每千克剂量(1.33 × 1014 vg/kg)除以每毫升本品悬浮液的载体基因组拷贝数(1.33 × 1013 vg/mL)
所需的本品瓶数= 本品剂量(mL)除以10(四舍五入至最接近的瓶数)。
【不良反应】
最常见的不良反应(发生率≥5%)是呕吐和恶心,肝功能受损,发热和血小板减少。
【药理作用】
本品是重组基因治疗产品,其由非复制型重组腺相关病毒(AAV)血清型rh74 (AAVrh74)衣壳和ssDNA表达盒组成,所述表达盒的侧翼是源自AAV2的反向末端重复序列(ITRs)。该盒包含:1)包含肌酸激酶7启动子和α-肌球蛋白重链增强子的MHCK7基因调节成分,和2)编码工程本品微肌营养不良蛋白的DNA转基因。载体/衣壳:临床和非临床研究已经证明AAVrh74血清型在骨骼肌细胞中的转导。此外,在非临床研究中,AAVrh74血清型转导已在心脏和膈肌细胞中得到证实。
启动子:MHCK7启动子/增强子驱动转基因表达,并已在动物模型中显示驱动转基因本品micro-dystrophin蛋白主要在骨骼肌(包括膈肌)和心肌中表达。在临床研究中,肌肉活检分析已经证实本品在骨骼肌中的表达。
转基因:DMD是由DMD基因突变引起的,导致缺乏功能性肌营养不良蛋白。本品携带编码微肌营养不良蛋白的转基因,该蛋白由在正常肌肉细胞中表达的肌营养不良蛋白的选定结构域组成。本品微肌营养不良蛋白已被证明定位于肌膜。
【贮藏】
-本品应在≤−60ºC温度下运输。
-直立冷藏存放在2℃至8℃的温度下最长14天。
-切勿再次冷冻
-切勿摇晃本品
-一旦恢复到室温,不能再放回冰箱。
-应遵循当地的生物废弃物处理指南进行本品丢弃。
【有效期】
在≤−60º温度下冷冻保存12个月
【使用方法】
-本品治疗需要选择抗AAVrh74总抗体滴度<1:400的患者。
-本品仅供静脉输注,且每次持续输注至少1-2小时,输注速度小于10mL/kg/小时。
-在注射本品之前:
*由于严重全身性免疫反应的风险增加,感染患者应推迟用药,直至感染消退。本品治疗期间,不应出现明显的临床感染症状或体征。
*评估肝功能。
*获取血小板计数和肌钙蛋白-I水平。使用总结合抗体酶联免疫吸附试验(ELISA)测量基线抗AAVrh74抗体滴度。不建议抗AAVrh74总结合抗体滴度升高(≥1:400)的患者使用本品。不建议再次使用本品。对AAVrh74载体的免疫反应可使用本品后发生。
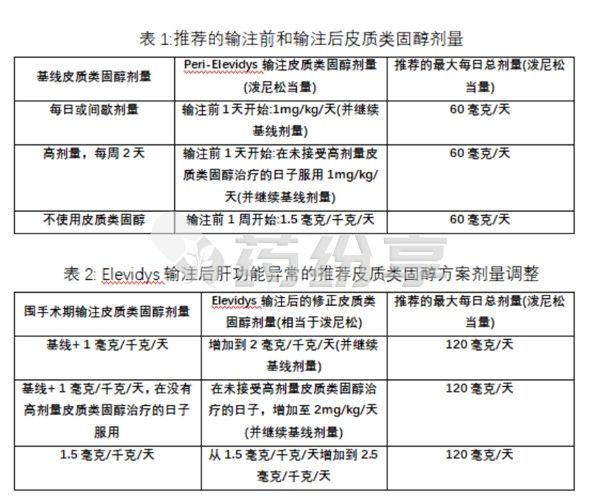
*为了降低与免疫反应相关的风险,应在注射本品前1天开始使用皮质类固醇并且建议在本品输注后至少60天内继续使用皮质类固醇(见表1),除非有临床指征提前减量。表2列出了对使用本品输注后出现肝功能异常的患者建议的皮质类固醇方案剂量调整。如果怀疑急性严重肝损伤,建议咨询医生。
*对于之前在基线时服用皮质类固醇的患者,在2周或根据需要更长时间内逐渐减少额外的围绝经期皮质类固醇(回到基线皮质类固醇剂量)。对于基线时未服用皮质类固醇的患者,根据需要在4周或更长时间内逐渐停止服用皮质类固醇(回到无皮质类固醇状态),并且皮质类固醇不应突然停用。
【推荐剂量】
推荐剂量为1.33 × 1014载体基因组/公斤体重,或10ml/公斤体重
本品剂量(ml)=患者体重(公斤)x 10
倍增因子10代表每千克剂量(1.33 × 1014 vg/kg)除以每毫升本品悬浮液的载体基因组拷贝数(1.33 × 1013 vg/mL)
所需的本品瓶数= 本品剂量(mL)除以10(四舍五入至最接近的瓶数)。
【剂量调整】
无
【服用过量处理】
无
【漏服处理】
无
【不良反应】
最常见的不良反应(发生率≥5%)是呕吐和恶心,肝功能受损,发热和血小板减少。
【注意事项】
- 急性严重肝损伤
使用本品治疗期间观察到急性严重肝损伤。在本品开始治疗之前,需要监测患者的肝功,并且本品治疗后的前3个月,每周监测肝功能(临床检查、GGT和总胆红素)。如果有临床指征,继续监测,直到结果不显著(正常临床检查、GGT和总胆红素水平恢复至接近基线水平)。如果怀疑急性严重肝损伤,建议咨询医生。
-免疫介导的肌炎
在临床试验中,在DMD基因外显子8和/或外显子9缺失突变的患者,在使用本品治疗后约1个月观察到免疫介导的肌炎。如果患者出现任何原因不明的肌肉疼痛、压痛或虚弱,包括吞咽困难、呼吸困难或垂体功能低下等炎症症状,应考虑增加使用额外的免疫调节治疗。
-心肌炎
在临床试验中,接受本品治疗的患者观察到急性严重心肌炎和肌钙蛋白-I升高。注射本品前和注射后第一个月每周监测肌钙蛋白-I。
- 针对AAVrh74的预存免疫
在本品给药之前,对抗AAVrh74总结合抗体的存在进行基线测试。不建议抗AAVrh74总结合抗体滴度升高(≥1:400)的患者使用本品。
【禁忌】
禁用于DMD基因第8和/或第9外显子有任何缺失的患者。
【特殊人群】
-妊娠
本品不适用于孕妇。
-哺乳期
没有关于本品在母乳中分泌、对母乳喂养婴儿的影响或对泌乳量的影响的数据。
-儿童患者:
尚未确定本品在3岁及以下和6岁及以上儿童患者中的有效性和安全性。
【适应症】
本品是一种基于腺相关病毒(AAV rh74)的基因疗法,用于治疗4至5岁儿童患者的已确定携带DMD基因突变的杜氏肌营养不良症(DMD)。
【药物相互作用】
在开始使用本品之前所需的皮质类固醇方案之前,请考虑患者的疫苗接种情况。如果可能的话,应根据当前的疫苗接种计划为患儿接种最新疫苗。疫苗接种应在皮质类固醇疗法开始前至少4周完成。




 在线咨询
在线咨询 400-001-9769
400-001-9769
