【适应症】
本品与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合给药,适用于伴有骨或骨髓病变,对既往治疗表现为部分缓解、轻微缓解或疾病稳定的复发性或难治性高危神经母细胞瘤的儿童(1 岁及以上)或成人患者。
【推荐剂量】
在每个治疗周期的第1、3和5天,本品的建议剂量为3mg/kg/天(最高150mg/天),在稀释后静脉输注,与皮下注射的GM-CSF联合给药。
治疗周期每4周重复一次,直至完全缓解或部分缓解,随后再连续用5个周期(每4周一个周期)。
后续周期可每8周重复一次。如发生疾病进展或不可接受的毒性,考虑停用本品和GM-CSF。 在输注期间酌情给予预先药物和支持治疗。
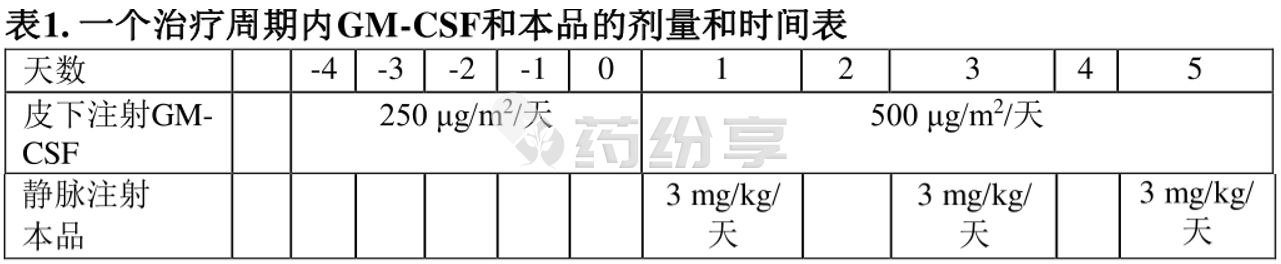
每个治疗周期的建议剂量方案如下:
第-4天至第0天:通过皮下注射给予GM-CSF250μg/m2/天,从本品输注前5天开始。
第1天至第5天:通过皮下注射给予GM-CSF500μg/m2/天。
在第1、3和5天,GM-CSF给药须发生在本品给药至少1小时之前。
第1、3和5天:通过静脉输注给予本品3mg/kg/天(最高150mg/天)。
【不良反应】
-最常见的不良反应(≥25%):
输液相关反应、疼痛、心动过速、呕吐、咳嗽、恶心、腹泻、食欲下降、高血压、疲劳、多形红斑、周围神经病、荨麻疹、发热、头痛、注射部位反应、水肿、焦虑、局部水肿和易怒。
-最常见的3级或4级实验室异常(≥5%):
淋巴细胞减少、中性粒细胞减少、血红蛋白减少、血小板计数减少、钾减少、丙氨酸转氨酶增加、葡萄糖减少、钙减少、白蛋白减少、钠减少和磷酸盐减少。
【药理作用】
那西妥单抗可特异性结合神经母细胞瘤细胞过表达的双唾液酸神经节苷脂 2(GD2)的糖脂部分。GD2 可在神经母细胞瘤细胞和其他神经外胚层细胞(包括中枢神经系统和外周神经)中过表达。 在体外试验中,那西妥单抗能够与细胞表面 GD2 结合并诱导 CDC 和 ADCC 效应。
【贮藏】
在2℃-8℃ (36℉-46℉) 下避光冷藏储存
【有效期】
24个
【使用方法】
-预先用药和支持性用药
输注前和输注期间的疼痛管理
1)在每个周期首次输注本品前5天,开始一个12天疗程(第-4天至第7天)的针对神经病理性疼痛的预防性用药,如如加巴喷丁。
2)每次本品输注开始前45-60分钟给予口服阿片类药物,并在输注期间根据需要额外静脉给予阿片类药物以缓解爆发性疼痛。
3)考虑使用氯胺酮治疗阿片类药物未能完全控制的疼痛。
预先用药:降低输注相关反应和恶心/呕吐的风险。
1)在首次输注本品前30分钟至2小时给予静脉注射皮质类固醇(如甲基强的松龙2mg/kg(最大剂量80mg)或其他皮质类固醇的等效剂量)。如果在既往输注中或在既往周期中发生了重度输注反应,则在后续输注前给予皮质类固醇预先用药。
2)在每次输注前30分钟给予抗组胺药、H2受体拮抗剂、对乙酰氨基酚和止吐药。
-配制
1)使用适当的无菌技术。
2)给药前目视检查药瓶中是否有颗粒物和变色。如果溶液变色、混浊或含有颗粒物,请丢弃药瓶。
3)将适量的5%(人)白蛋白和0.9%氯化钠注射液加入一个空的无菌静脉输液袋中。静置5-10分钟进行被动混合。
4)取所需剂量的本品,并注射到含有5%(人)白蛋白和0.9%氯化钠注射液的输液袋中。丢弃瓶中剩余的任何未使用的本品。
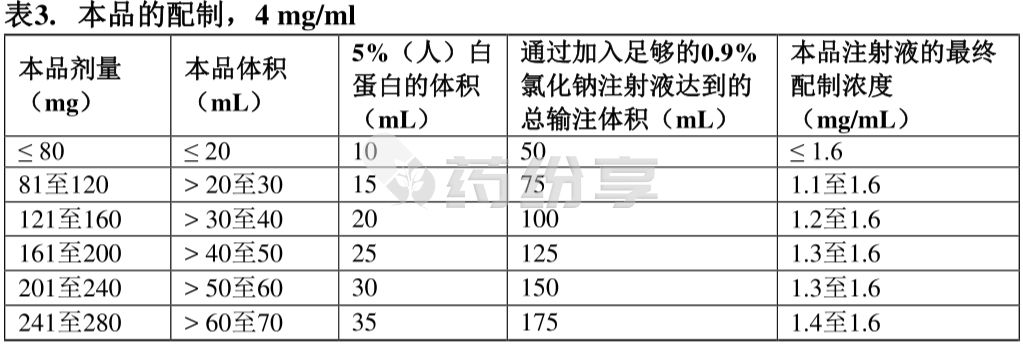
如果不马上使用,稀释后的本品注射液在室温(15℃至25℃)下最多储存8小时或冷藏(2℃至8℃)时最多24小时。一旦从冰箱中取出,在8小时内开始输注。
-给药
1)按推荐的方式静脉输注稀释后的本品。不要以静脉推注或弹丸注射的方式给予本品。
2)第一次输注(第1周期,第1天)时,在60分钟内静脉给予本品。
3)对于随后的输注,如果耐受,可在30至60分钟内静脉给予本品。
4)每次输注后至少观察2小时。
【剂量调整】
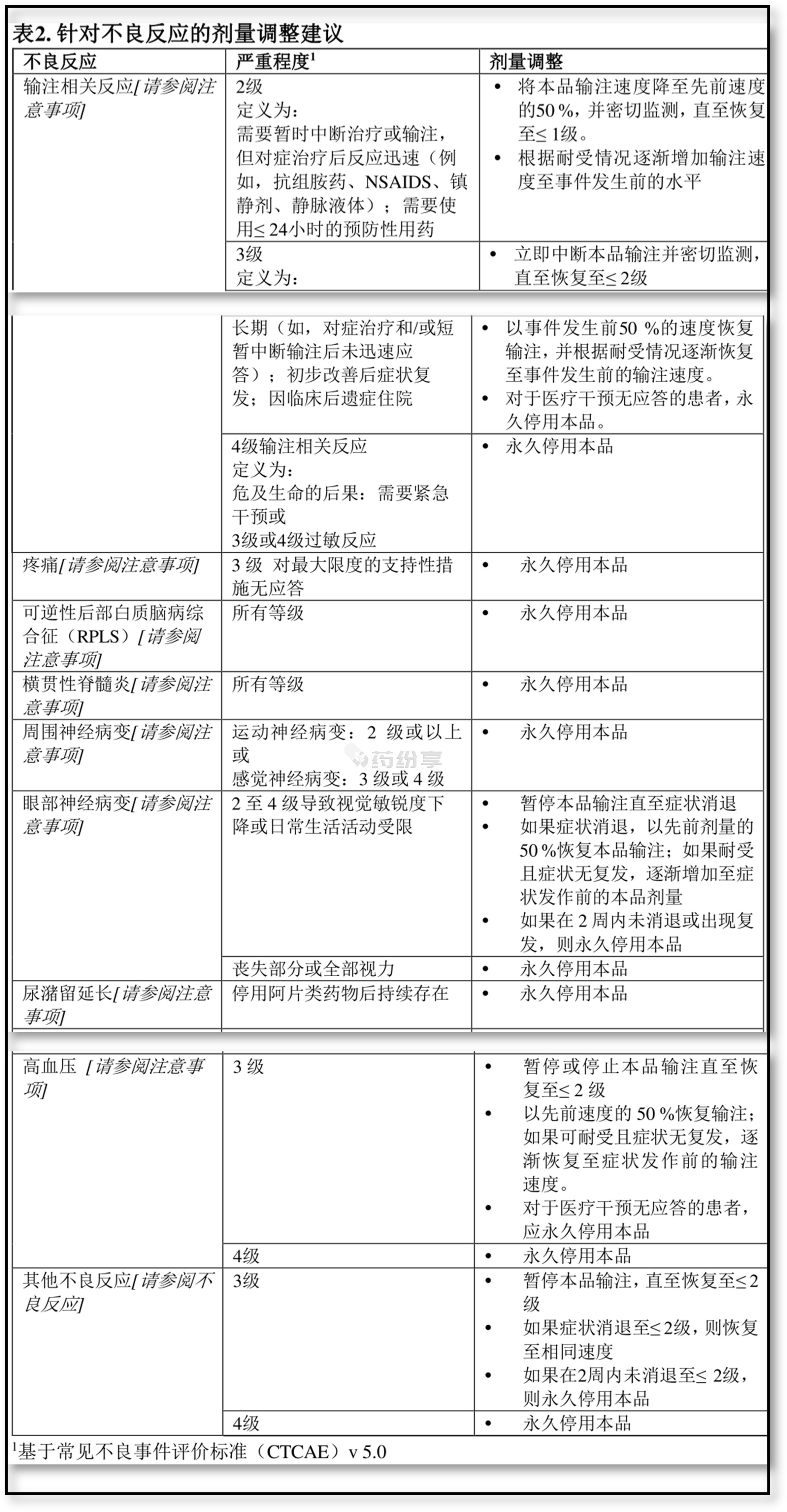
本品不良反应的推荐剂量调整如表2所示。
【漏服剂量】
如果发生本品某剂输注遗漏,则在下一周(第10天内)给予遗漏的剂量。分别在本品输注的第一天以及第二次和第三次输注的前一天和当天给予GM-CSF 500μg/m2/天(即500μg/m2/天,共五天)。
【不良反应】
-最常见的不良反应(≥25%):
输液相关反应、疼痛、心动过速、呕吐、咳嗽、恶心、腹泻、食欲下降、高血压、疲劳、多形红斑、周围神经病、荨麻疹、发热、头痛、注射部位反应、水肿、焦虑、局部水肿和易怒。
-最常见的3级或4级实验室异常(≥5%):
淋巴细胞减少、中性粒细胞减少、血红蛋白减少、血小板计数减少、钾减少、丙氨酸转氨酶增加、葡萄糖减少、钙减少、白蛋白减少、钠减少和磷酸盐减少。
【注意事项】
-严重的输注相关反应:
本品可引起需要紧急干预的严重输注反应,包括体液复苏、支气管扩张剂和皮质类固醇给药、重症监护病房入院、降低输注速度或暂时中断本品输注。输注相关反应包括低血压、支气管痉挛、缺氧和喘鸣。
建议使用抗组胺药、对乙酰氨基酚、H2受体拮抗剂和皮质类固醇作为预先用药。在备有心肺复苏药物和设备的环境中,密切监测患者输注期间和输注完成至少2小时内的输注反应体征和症状。
根据严重程度降低输注速度、暂时中断输注或永久停用本品,并根据需要进行适当的医疗管理。
-神经毒性:
本品可引起重度神经毒性,包括重度神经病理性疼痛、横贯性脊髓炎和可逆性后部白质脑病综合征。本品治疗期间,监测患者的神经毒性体征和症状,根据严重程度降低输注速度、暂时中断输注或永久停用本品,并根据需要进行适当的医疗管理。
-高血压:
接受本品治疗的患者出现了高血压。高血压未得到控制的患者,请勿开始本品治疗。在本品输注期间以及每个周期第1-8天至少每天监测血压,并评估高血压并发症(包括RPLS),根据严重程度降低输注速度、暂时中断输注或永久停用本品。
-胚胎-胎儿毒性:
根据作用机制,本品在妊娠女性使用后可能会造成胎儿伤害。应告知育龄女性(包括妊娠女性)对胎儿的潜在风险。建议育龄女性在使用本品治疗期间以及最后一剂给药后的2个月内使用有效的避孕方法。
【特殊人群】
-妊娠:
根据作用机制,本品在妊娠女性使用后可能会造成胎儿伤害。目前尚无妊娠女性使用本品的数据,也尚未使用本品进行动物生殖研究。随着妊娠进展,IgG1单克隆抗体可透过胎盘屏障并随妊娠进展线性增加,在妊娠晚期透过量最大。应告知妊娠女性对胎儿的潜在风险。
-哺乳期:
尚无数据显示人乳汁中是否存在那西妥单抗或者其对母乳喂养的儿童或泌乳量的影响,但人乳汁中是存在人IgG的。本品可能增加母乳喂养的儿童出现严重不良反应的潜在风险,因此建议女性在本品治疗期间以及最后一剂给药后的2个月内不要母乳喂养。
-育龄女性和男性:
本品给予妊娠女性可能会造成胎儿伤害。在开始本品使用之前确认育龄女性的妊娠状态。建议育龄女性在使用本品治疗期间及最后一剂给药后的2个月内使用有效的避孕方法。
-儿童:
在1岁以下儿童患者中尚未建立安全性和有效性。
-老年人:
本品的临床试验研究未纳入年龄65岁及以上的患者。
【禁忌】
本品禁用于对那西妥单抗有重度超敏反应史的患者。
【适应症】
本品与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合给药,适用于伴有骨或骨髓病变,对既往治疗表现为部分缓解、轻微缓解或疾病稳定的复发性或难治性高危神经母细胞瘤的儿童(1 岁及以上)或成人患者。
【药物相互作用】
未开展药物相互作用相关研究。


 在线咨询
在线咨询 400-001-9769
400-001-9769
