【适应症】
本品联合含氟嘧啶和含铂化疗,适用于HER2阴性、CLDN18.2阳性、局部晚期不可切除或转移性的胃癌或胃食管交界处 (GEJ) 腺癌成人患者的一线治疗。
【推荐剂量】
本品推荐剂量应根据患者体表面积 (BSA) 计算。本品给药应联合氟嘧啶 - 和含铂化疗。
-起始剂量:800mg/m2 ,静脉输注,且持续输注至少2个小时。
-后续剂量:起始剂量给药3周后,给予600mg/m2,静脉输注,每3周一次;或起始剂量给药2周后,给予400mg/m2,静脉输注,每2周一次。持续用药,直至出现疾病进展或不可耐受的毒性。
【不良反应】
最常见的不良反应(≥20%):恶心、呕吐、食欲减退、中性粒细胞减少症及体重减轻。
【药理作用】
本品是一种抗人 CLDN18.2 的抗体,与胃癌细胞细胞膜上表达的 CLDN18.2 结合,由于抗体依赖性细胞毒性 (ADCC) 活性和补体依赖性细胞毒性 (CDC) 活性,被认为表现出肿瘤生长抑制作用
【贮藏】
在2-8°C冷藏下储存。
切勿冷冻。
放置于原包装盒内保存,避光。
【有效期】
日版:40 个月;欧盟版:4年(未开封)
【使用方法】
-本品静脉输注给药,切勿静脉推注或快速滴注,每次持续输注至少2个小时。
-由于恶心和呕吐经常出现,因此在服用该药物之前应考虑预防性服用止吐药。
-如果患者在使用本品前出现恶心和/或呕吐,则在进行首次输注之前,症状应消退至 ≤1 级。
-复溶时,沿本剂小瓶内壁缓慢无菌注入,缓慢搅拌不振动,完全溶解。 溶解后,应让样品瓶静置,直到没有气泡。 不要暴露在阳光直射下。
-复溶后的液体呈无色至微黄色透明或微乳白色光。 目视检查,如果发现颗粒物或变色,请在不使用的情况下将其丢弃。
-复溶后未立即稀释,常温下保存不宜超过5小时。
-稀释后的浓度为 2.0 mg/mL。 轻轻翻转输液袋,使溶液不会起泡。 不要暴露在阳光直射下。
- 目视检查稀释液,如果发现颗粒物,请勿使用。
-稀释后的溶液应立即使用,并在室温下稀释后6小时内完成给药。 如果必须储存稀释的溶液,请在 2 至 8 °C 下储存,并在稀释后 24 小时内使用并处理剩余的液体。
-不要与其他药物使用相同的输液管共同给药。
【推荐剂量】
本品推荐剂量应根据患者体表面积 (BSA) 计算。本品给药应联合氟嘧啶 - 和含铂化疗。
-起始剂量:800mg/m2 ,静脉输注,且持续输注至少2个小时。
-后续剂量:起始剂量给药3周后,给予600mg/m2,静脉输注,每3周一次;或起始剂量给药2周后,给予400mg/m2,静脉输注,每2周一次。持续用药,直至出现疾病进展或不可耐受的毒性。
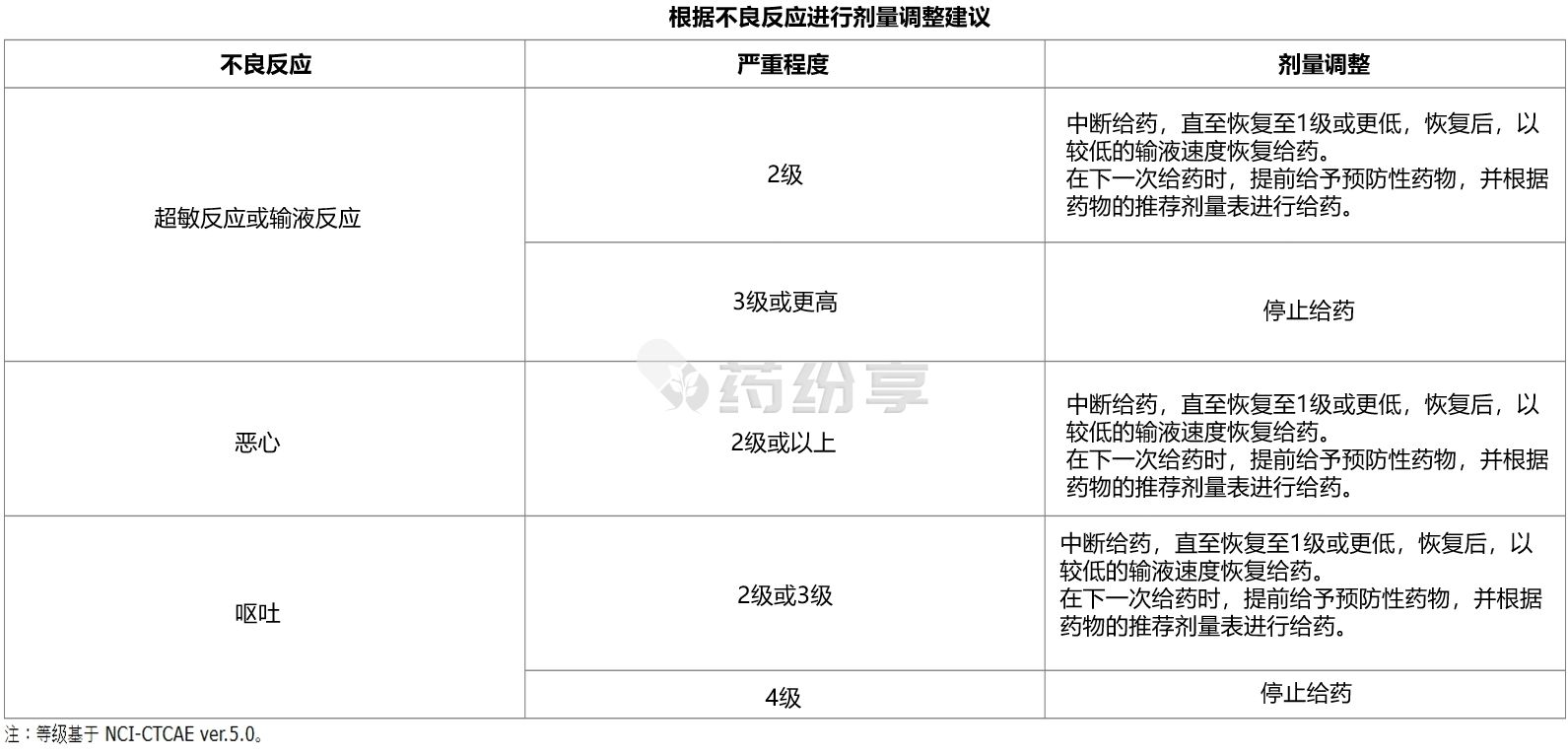
【剂量调整】
【服用过量处理】
如果药物过量,应密切监测患者的不良反应和应酌情进行支持治疗。
【漏服处理】
无
【不良反应】
最常见的不良反应(≥20%):恶心、呕吐、食欲减退、中性粒细胞减少症及体重减轻。
【注意事项】
-超敏反应:
接受本品联合氟嘧啶和含铂治疗的患者,已发生超敏反应,包括过敏反应和药物超敏反应。在本品输注期间和之后,应监测患者(至少 2 小时,如果有临床指征)用于具有高度提示性症状和体征的超敏反应过敏反应(荨麻疹、反复咳嗽、喘息和喉咙发紧/声音改变)。
-输液相关反应:
在本品与氟嘧啶和含铂化疗联合使用的临床研究中发生了输注相关反应 (IRR)。
应监测患者输液相关反应的体征和症状,包括恶心、呕吐、腹痛、唾液分泌过多、发热、胸部不适、发冷、背痛、咳嗽、和高血压。这些体征和症状通常是可逆的。
-恶心和呕吐:
在本品联合氟嘧啶和含铂化疗的不良反应临床研究期间,恶心和呕吐是最常见的胃肠道症状。
为防止恶心和呕吐,在每次本品输注之前,建议联合使用止吐药进行预处理。在本品输注期间和输注后,应使用标准护理对患者进行监测和管理,包括根据临床指征,止吐药或补液。
【禁忌】
对本品活性物质或任何赋形剂过敏者,禁用本品。
【特殊人群】
-孕妇:
孕妇或可能怀孕的妇女只有在判断治疗获益大于风险时才应给予。 已知人 IgG 可穿过胎盘。 在动物试验(小鼠)中,已在胎儿血清中发现这种试剂。
-哺乳:
最好不要母乳喂养。 尚未研究该药物转移到母乳中,但据报道,人 IgG 会转移到母乳中。 如果婴儿通过牛奶摄入药物,婴儿有出现严重副作用的风险。
-儿童:
尚未进行儿童临床试验。
【适应症】
本品联合含氟嘧啶和含铂化疗,适用于HER2阴性、CLDN18.2阳性、局部晚期不可切除或转移性的胃癌或胃食管交界处 (GEJ) 腺癌成人患者的一线治疗。
【药物相互作用】
尚未进行本品正式的药代动力学药物相互作用研究。
请按药品说明书或在药师指导下购买和使用




 在线咨询
在线咨询 400-001-9769
400-001-9769
