【适应症】
本品用于治疗:
-新诊断的多形性胶质母细胞瘤(GBM),先与放疗联合治疗,随后作为维持治疗。
-常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤。
【推荐剂量】
新诊断的多形性胶质母细胞瘤(GBM)的成人患者:
替莫唑胺先与局部放疗联合治疗(同步放化疗期),随后为最多6个周期的替莫唑胺(TMZ)单药治疗(维持治疗期)
同步放化疗期
口服本品,每日剂量为75mg/㎡,共42天,同时接受局部放疗(60Gy分30次)。根据患者耐受程度可暂停用药,但无需降低剂量。同步放化疗期如果符合以下条件:绝对中性粒细胞计数≧1.5x109/L,血小板计数≧100X109/L,普通毒性标准(CTC)-非血液学毒性≦1级(除脱发、恶心和呕吐外),本品可连续使用42天,最 多49天。治疗期间每周应进行全血细胞计数。在同步放化疗期间应按表1所示血液学和非血液学毒性标准暂停或终止服用本品。
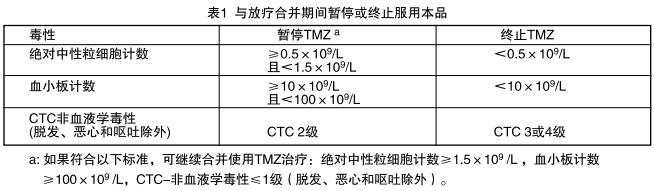
维持治疗期
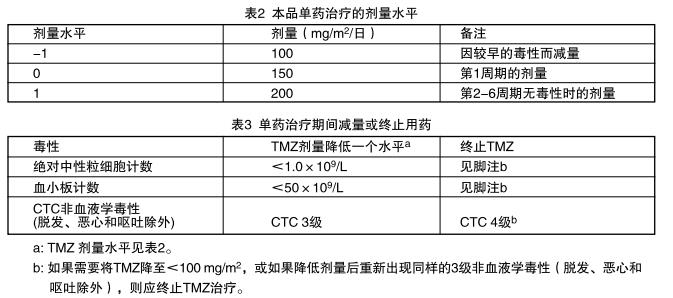
本品同步放化疗期结束后4周,进行6个周期的本品单药治疗。本品第1周期的剂量是150mg/㎡/日,每日一次,共5天,然后停药23天。第2周期开始时,如果第1周期CTC的非血液学毒性≦2级(除脱发、恶心和呕吐外)、绝对中性粒细胞计数(ANC)≧1.5x109/L和血小板计数≧100x109/L,则剂量可増至200mg/㎡/日。如果第2周期 的剂量没有增加,在以后的周期中也不应增加剂量。除出现毒性外,以后各周期的剂量维持在每日200mg/㎡。治疗期间应按表2和表3降低剂量。
治疗期间,第22天(首剂本品后21天)应进行全血细胞的计数。应按表3降低剂量或终止服用本品。
常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤成人患者:
对于以前未接受过化疗患者,本品口服剂量是每日200mg/㎡, 共5天。每28天为一周期。对于以前曾接受 过化疗患者,本品起始剂量是150mg/m2/日,如果下个周期第一天的ANC≧1.5x109/L和血小板计数≧100x109/L,则第2周期的剂量增为200mg/m2/日。应根据ANC和血小板计数最低值调整本品的剂量。
【不良反应】
新诊断的多形性胶质母细胞瘤
表4是新诊断为多形性胶质母细胞瘤患者在同步放化疗期和单药治疗期出现的不良事件(在临床试验中并未 判断因果关系)。
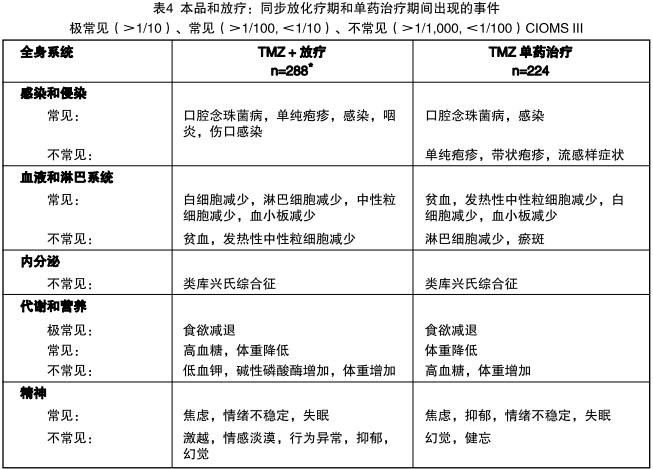
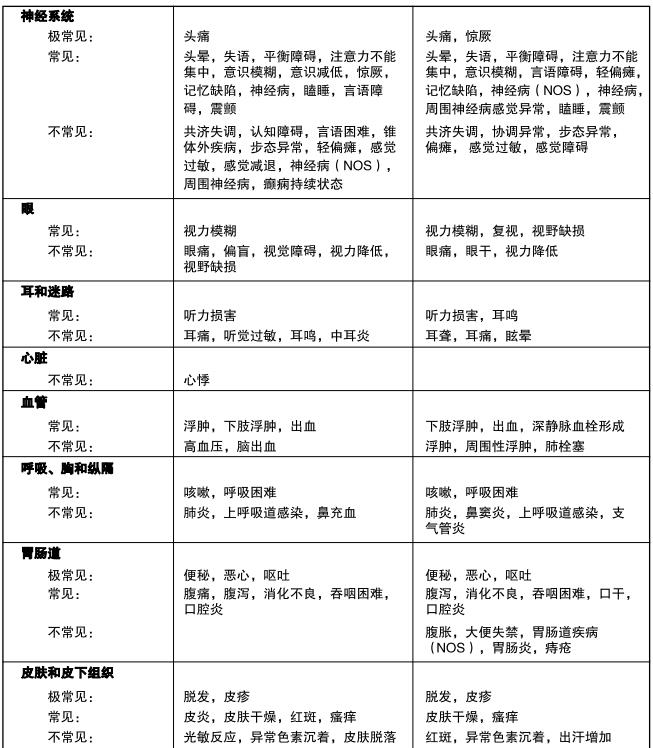
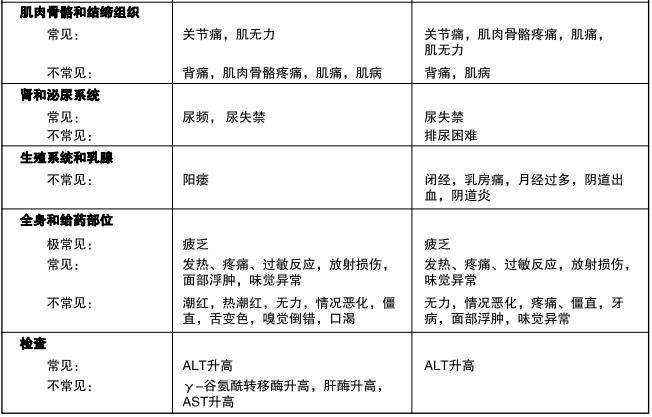
胶质瘤复发或进展的成人患者
临床试验中,最常发生的治疗相关不良反应是胃肠道反应,特别是恶心(43%)和呕吐(36%)。这些反应 —般为1级或2级(24小时内呕吐0-5次),具有自限性,或易于用标准止吐药控制。重度恶心和呕吐的发生率为4%。
【服用方法】
应空腹(进餐前至少一小时)服用本品。服用本品前后可使用止吐药。如果服药后出现呕吐,当天不能服用第2剂。
不能打开或咀嚼本品,应用一杯水整粒吞服。如果胶囊有破损,应避免皮肤或粘膜与胶囊内粉状内容物接触。
膜与胶囊内粉状内容物接触。
【推荐剂量】
新诊断的多形性胶质母细胞瘤(GBM)的成人患者:
替莫唑胺先与局部放疗联合治疗(同步放化疗期),随后为最多6个周期的替莫唑胺(TMZ)单药治疗(维持治疗期)
同步放化疗期
口服本品,每日剂量为75mg/㎡,共42天,同时接受局部放疗(60Gy分30次)。根据患者耐受程度可暂停用药,但无需降低剂量。同步放化疗期如果符合以下条件:绝对中性粒细胞计数≧1.5x109/L,血小板计数≧100X109/L,普通毒性标准(CTC)-非血液学毒性≦1级(除脱发、恶心和呕吐外),本品可连续使用42天,最 多49天。治疗期间每周应进行全血细胞计数。在同步放化疗期间应按表1所示血液学和非血液学毒性标准暂停或终止服用本品。

维持治疗期
本品同步放化疗期结束后4周,进行6个周期的本品单药治疗。本品第1周期的剂量是150mg/㎡/日,每日一次,共5天,然后停药23天。第2周期开始时,如果第1周期CTC的非血液学毒性≦2级(除脱发、恶心和呕吐外)、绝对中性粒细胞计数(ANC)≧1.5x109/L和血小板计数≧100x109/L,则剂量可増至200mg/㎡/日。如果第2周期 的剂量没有增加,在以后的周期中也不应增加剂量。除出现毒性外,以后各周期的剂量维持在每日200mg/㎡。治疗期间应按表2和表3降低剂量。
治疗期间,第22天(首剂本品后21天)应进行全血细胞的计数。应按表3降低剂量或终止服用本品。

常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤成人患者:
对于以前未接受过化疗患者,本品口服剂量是每日200mg/㎡, 共5天。每28天为一周期。对于以前曾接受 过化疗患者,本品起始剂量是150mg/m2/日,如果下个周期第一天的ANC≧1.5x109/L和血小板计数≧100x109/L,则第2周期的剂量增为200mg/m2/日。应根据ANC和血小板计数最低值调整本品的剂量。
【服用方法】
应空腹(进餐前至少一小时)服用本品。服用本品前后可使用止吐药。如果服药后出现呕吐,当天不能服用第2剂。
不能打开或咀嚼本品,应用一杯水整粒吞服。如果胶囊有破损,应避免皮肤或粘膜与胶囊内粉状内容物接触。
【不良反应】
新诊断的多形性胶质母细胞瘤
表4是新诊断为多形性胶质母细胞瘤患者在同步放化疗期和单药治疗期出现的不良事件(在临床试验中并未 判断因果关系)。



胶质瘤复发或进展的成人患者
临床试验中,最常发生的治疗相关不良反应是胃肠道反应,特别是恶心(43%)和呕吐(36%)。这些反应 —般为1级或2级(24小时内呕吐0-5次),具有自限性,或易于用标准止吐药控制。重度恶心和呕吐的发生率为4%。
卡氏肺囊虫性肺炎:
在一项治疗时间延长到42天的小规模试验中,接受本品和放疗合并治疗的患者是卡氏肺囊虫性肺炎(PCP)的高危者。因此无论淋巴细胞计数如何,对于接受42天(最多为49天)合并治疗的全部患者,需要预防卡氏肺 囊虫性肺炎发生。如果出现淋巴细胞减少,则应继续预防至淋巴细胞恢复至≦1级。
在较长期的给药方案治疗期间,接受替莫唑胺治疗期间卡氏肺囊虫性肺炎发生率可能较高。不管何种治疗方案,都应密切观察替莫唑胺治疗的全部患者发生卡氏肺囊虫性肺炎的可能性,特别是接受类固醇治疗的患者。在使用替莫唑胺的患者中曾报告致命的呼吸衰竭病例,尤其是与地塞米松或其他类固醇类联合治疗时。
肝毒性:
极少数使用替莫唑胺的患者出现肝脏损伤,包括致命的肝功能衰竭。在使用本品进行治疗前必须进行基线肝功能检查。如果基线肝功能异常,医生在开始替莫唑胺治疗前应进行风险获益评估,包括评估可能出现致命性肝功能衰竭的潜在风险。对于进行42天治疗周期的患者需要在治疗周期中间进行肝功能检查。对于所有的患 者,必须在每个治疗周期后进行肝功能的检查。对于有显著肝功能异常的患者,医生需要对是否继续治疗进行 风险获益评估。另外,肝脏毒性可能在使用本品后数周或更长时间出现。
此外,报告了由于乙型肝炎病毒再活动引起肝炎而致死的一些病例。在治疗开始前应对患者进行乙型肝炎病毒感染筛查。在替莫唑胺治疗期间和治疗结束后几个月内,监测既往存在乙型肝炎病毒感染的患者的乙型肝炎或HBV再活动的临床和实验室指征。对有证据表明活动性乙型肝炎感染的患者应停止治疗。
止吐治疗:
恶心和呕吐常与本品相关,服用本品前后可使用止吐药。指导原则为:
新诊断多形性胶质母细胞瘤的患者:
-在开始接受替莫唑胺合并治疗前,建议采用止吐药预防,
-在单药治疗期间.极力建议采用止吐药预防。
神经胶质瘤复发或进展的患者:在以前治疗周期中出现过重度(3或4级)呕吐的患者需要止吐药治疗。
骨髓抑制:
接受替莫唑胺治疗的患者可能会出现骨髓抑制,包括持续的全血细胞降低,可能导致再生障碍贫血,且在一些病例中导致了致命的结果。在一些病例中,如同时服用其他与再生障碍贫血有关的药物(包括卡马西平、苯妥英、复方磺胺甲恶唑),会使评估更为困难。
男性患者:
服用替莫唑胺的男性患者应采取有效的避孕措施。替莫唑胺具有遗传毒性,因此在治疗过程及治疗结束后6 个月之内,男性应避孕。由于接受替莫唑胺治疗有导致不可逆不育的可能,在接受该治疗之前应冰冻保存精子。乳糖:
本品含有乳糖。患有罕见的遗传性半乳糖不耐受、乳糖酶缺乏或葡萄糖-半乳糖吸收不良问题的患者,不应服 用本品。
对驾驶和操作机械能力的影响
替莫唑胺可导致疲劳和嗜睡,应避免对驾驶和操作机械能力的影响。
【适应症】
本品用于治疗:
-新诊断的多形性胶质母细胞瘤(GBM),先与放疗联合治疗,随后作为维持治疗。
-常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤。
在一项单独的I期研究中,同时服用雷尼替丁未改变替莫唑胺胶囊的吸收程度或对其活性代谢产物单甲基三氮烯咪唑甲酰胺(MTIC)的暴露。
根据II期试验中的一项群体药代动力学分析,同时服用地塞米松、丙氯拉嗪、苯妥英、卡马西平、昂丹司琼、H2受体拮抗剂或苯巴比妥等,不影响替莫唑胺的清除。同时服用丙戊酸,替莫唑胺清除率出现轻度但有统计学意义的降低。
尚未研究考察替莫唑胺对其他药品代谢或消除的影响。然而,替莫唑胺不经肝脏代谢,且蛋白结合低,因此不太可能影响其他药品的药代动力学。
替莫唑胺胶囊与其他可导致骨髓抑制的药物联合应用时,骨髓抑制可能加重。
请按药品说明书或在药师指导下购买和使用





 在线咨询
在线咨询 400-001-9769
400-001-9769
