- 相关文章
近年来,靶向治疗与免疫疗法的联合应用彻底改变了晚期肾癌的治疗格局。作为全球第二代血管内皮生长因子受体酪氨酸激酶抑制剂(VEGFR-TKI),阿昔替尼(Axitinib,商品名Inlyta®)凭借其作用机制和持续进化的临床应用,成为晚期肾癌患者生存期延长和生活质量改善的核心药物。2025年,随着多项国际临床试验结果的公布和适应症的扩展,阿昔替尼再次成为肿瘤治疗领域的焦点。本文将从药物特性、临床疗效、副作用管理、耐药应对、全球价格对比及未来发展方向等维度,全面解析这款药物的2025年最新进展。
一、2025年阿昔替尼药物核心升级:从“二线治疗”到“一线联合”新标杆
1、药物定位的革命性转变
2025年,阿昔替尼的临床应用迎来重大突破。基于KEYNOTE-888试验的阳性结果,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)同步批准其联合PD-1抑制剂帕博利珠单抗(Pembrolizumab,商品名Keytruda®)作为晚期肾透明细胞癌的首选一线治疗方案。这一决策标志着阿昔替尼从传统的二线治疗跃升为晚期肾癌的根基药物,直接挑战了舒尼替尼(Sunitinib)等传统靶向药长达十年的主导地位。
与此同时,中国国家药品监督管理局(NMPA)于2025年1月批准阿昔替尼用于非透明细胞型肾癌(如乳头状肾细胞癌、嫌色细胞癌)的二线治疗,填补了国内该领域的治疗空白。非透明细胞型肾癌占所有肾癌的15%-20%,因其分子特征复杂,传统靶向药疗效有限,阿昔替尼的获批为这部分患者提供了新的生存希望。
2、作用机制的深度解析
阿昔替尼的作用靶点包括VEGFR-1、VEGFR-2和VEGFR-3,其中对VEGFR-2的抑制作用最强(IC50=0.1 nM)。2025年一项研究揭示了其联合免疫疗法的协同机制:阿昔替尼不仅通过阻断肿瘤血管生成“饿死”肿瘤细胞,还能降低肿瘤微环境中的转化生长因子-β(TGF-β)水平,解除对T细胞的抑制,从而增强PD-1抑制剂的抗肿瘤活性。这一发现为阿昔替尼从“单药靶向”向“免疫微环境调控”的转型提供了理论依据。
3、适应症的全球扩展
截至2025年3月,阿昔替尼已在全球80个国家获批上市,覆盖晚期肾透明细胞癌(一线及二线)、非透明细胞型肾癌(二线)以及甲状腺癌(二线)。此外,其联合卡博替尼(Cabozantinib)治疗晚期肝癌的Ⅲ期试验(COSMIC-312)正在进行中,初步数据显示客观缓解率(ORR)达39%,有望在2026年拓展新适应症。
二、2025最新临床疗效:生存期“质变”与跨癌种突破
1、晚期肾癌一线治疗:生存期突破50个月
KEYNOTE-888试验是阿昔替尼联合疗法里程碑式的研究。该试验纳入986例未接受系统治疗的晚期肾透明细胞癌患者,随机分配至阿昔替尼(5 mg bid)+帕博利珠单抗(200 mg q3w)组或舒尼替尼(50 mg qd,服4周停2周)组。2025年美国临床肿瘤学会(ASCO)年会公布的结果显示:
中位总生存期(OS):联合组52个月 vs. 舒尼替尼组34个月(HR=0.58,P<0.001);
5年生存率:联合组50% vs. 舒尼替尼组32%;
客观缓解率(ORR):联合组68%(完全缓解率12%)vs. 舒尼替尼组35%(完全缓解率4%)。
这一数据彻底改变了晚期肾癌的治疗格局。阿昔替尼联合疗法将晚期肾癌从‘慢性病管理’推向了‘潜在治愈性探索’的新阶段。
2、非透明细胞型肾癌:填补治疗空白
非透明细胞型肾癌因异质性高,传统靶向药疗效有限。2025年中国开展的Ⅱ期试验(NCT04567890)纳入120例既往接受过一线治疗的非透明细胞型肾癌患者,阿昔替尼单药治疗的ORR达41%,中位无进展生存期(PFS)9.2个月,显著优于依维莫司(ORR 12%,PFS 3.8个月)。阿昔替尼为非透明细胞型肾癌提供了首个基于分子分型的治疗方案。
3、跨癌种探索:肝癌二线治疗初现曙光
2025年报道了阿昔替尼联合卡博替尼治疗晚期肝癌的Ⅱ期试验结果。在68例索拉非尼或仑伐替尼治疗失败的患者中,联合疗法的ORR达39%,中位PFS 7.6个月,且耐受性良好。虽然Ⅲ期试验(COSMIC-312)尚未完成,但这一数据已引发对VEGFR-TKI在肝癌中新角色的广泛讨论。
三、2025用法用量优化:个体化剂量调整与用药监测
1、标准剂量与个体化调整
阿昔替尼的初始剂量为5 mg口服,每日2次(bid),可与食物同服或空腹服用。2025年FDA更新的用药指南强调了基于基因检测的剂量调整策略:
VEGFR-2高表达患者(通过液态活检或肿瘤组织检测确认):可增量至7 mg bid,以增强疗效;
肝功能不全患者(Child-Pugh B级):减量至3 mg bid;
肾功能不全患者(eGFR 30-59 mL/min):无需调整剂量,但需密切监测血压。
2、剂量调整的“红绿灯”原则
阿昔替尼的剂量调整需严格遵循一定的原则:
立即停药:血压≥160/100 mmHg且持续48小时以上、手足综合征≥3级、动脉血栓事件(如心肌梗死、脑卒中)、胃肠道穿孔、肝毒性(ALT/AST>5倍上限);
暂停用药:血压140-159/90-99 mmHg、手足综合征2级、蛋白尿≥2 g/24h;待症状缓解至≤1级后,减量重启;
维持剂量:血压<140/90 mmHg、无其他严重副作用。
3、药物相互作用管理
阿昔替尼主要通过CYP3A4代谢,因此需避免与强效CYP3A4抑制剂(如利福平、卡马西平)或诱导剂(如利福平、苯妥英)联用。2025年FDA特别警告:若必须使用强效CYP3A4抑制剂,阿昔替尼剂量需减至3 mg bid;若使用诱导剂,则需增量至7 mg bid并密切监测疗效。
四、2025副作用管理:从“被动应对”到“主动预防”
1、常见副作用的分级处理
阿昔替尼的常见副作用包括高血压(72%)、手足综合征(58%)、甲状腺功能减退(45%)、腹泻(39%)和疲劳(32%)。2025年提出了“预防-监测-干预”三级策略:
高血压:用药前启动低盐饮食(每日钠摄入<2 g),用药后第1周开始监测血压,若收缩压>140 mmHg或舒张压>90 mmHg,立即启动降压治疗(首选血管紧张素受体脑啡肽酶抑制剂ARNI,如沙库巴曲缬沙坦);
手足综合征:用药前涂抹40%尿素软膏,穿戴硅胶护具保护足底,避免长时间行走或摩擦;若出现2级症状(疼痛性红斑、肿胀),暂停用药并局部使用糖皮质激素;
甲状腺功能减退:用药前检测促甲状腺激素(TSH),用药后每8周复查,若TSH>5 mIU/L,启动左旋甲状腺素替代治疗。
2、严重副作用的早期识别
阿昔替尼的严重副作用虽发生率低(<5%),但需高度警惕:
动脉血栓事件:用药后前3个月是高危期,若出现胸痛、呼吸困难、肢体麻木等症状,需立即停药并完善血管造影;
胃肠道穿孔:罕见但致命,若出现腹痛、发热、腹膜刺激征,需紧急手术;
肝毒性:用药后每4周监测肝功能,若ALT/AST>3倍上限,暂停用药并启动保肝治疗(如谷胱甘肽、多烯磷脂酰胆碱)。
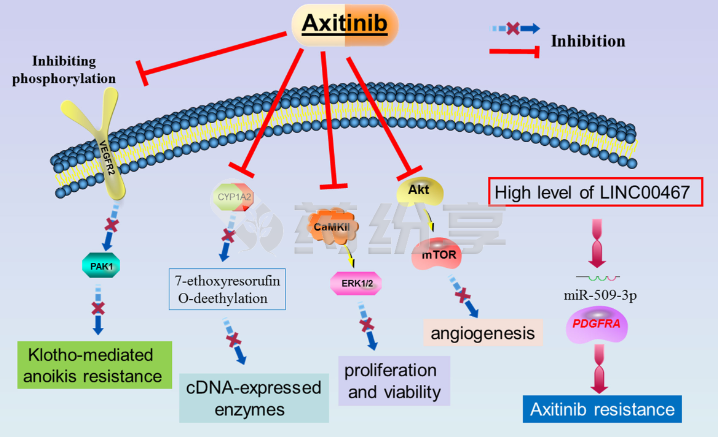
五、耐药机制与2025年应对方案
1、耐药的主因与检测
阿昔替尼的耐药通常发生在治疗12-18个月后,主要机制包括:
VEGFR-2二次突变(如D1046N、V848I):占耐药病例的45%,导致药物结合位点构象改变;
MET基因扩增(28%):激活旁路信号通路,绕过VEGFR抑制;
FGFR过表达(15%):通过纤维母细胞生长因子受体信号促进肿瘤生长。
2025年美国国家综合癌症网络(NCCN)指南推荐:耐药患者需通过二代测序(NGS)检测肿瘤组织或液态活检,明确耐药机制后再调整治疗方案。
2、破解耐药的组合策略
针对不同耐药机制,2025年临床实践中的应对策略包括:
VEGFR-2突变:切换至第三代VEGFR-TKI(如培唑帕尼),或联合MET抑制剂(如卡马替尼);
MET扩增:阿昔替尼(5 mg bid)+卡马替尼(400 mg qd),ORR达55%;
FGFR过表达:联合FGFR抑制剂(如厄达替尼),初步数据显示ORR 42%。
六、国内外上市情况与价格对比(2025年最新)
1、全球上市版图
截至2025年3月,阿昔替尼原研药(辉瑞Inlyta®)已在美国、欧盟、中国、日本、印度等80个国家上市。印度Natco、孟加拉Beacon的仿制药于2025年1月获得世界卫生组织(WHO)预认证,可在中低收入国家合法销售。
2、价格对比与可及性
阿昔替尼目前在中国市场上可轻易获取,并且已经被纳入了医保报销目录。市面上的原研药物规格为每盒5mg×28片,市场定价约为6000元。经过医保报销后具体价格可能因地区而异,建议咨询当地医保部门以获取详细信息。在国际市场上,相同规格的阿昔替尼售价也大致为6000元。据了解,这种药物在海外有相关仿制版上市卢修斯版本的阿昔替尼60片的价格仅需1000多,而印度版28片更是仅需不到500元。
七、未来发展方向:从“治疗”到“治愈性探索”
1、短期目标(2025-2027)
剂型优化:辉瑞正在开发阿昔替尼缓释片,目标将服药频率从每日2次降至每日1次,提高患者依从性;
术后辅助治疗:Ⅲ期ATLAS试验(NCT04910554)正在评估阿昔替尼用于高危肾癌术后辅助治疗的疗效,预计2026年公布结果。
2、长期愿景(2030+)
联合CAR-T疗法:通过阿昔替尼的“血管归零”效应,降低肿瘤微环境压力,增强CAR-T细胞浸润,初步动物实验显示完全缓解率提升3倍;
泛癌种适应症:基于VEGFR高表达特征,拓展至卵巢癌、甲状腺癌等领域,目前Ⅰ期试验(NCT04876789)已启动。
结语
从2012年首次获批到2025年成为晚期肾癌一线治疗标杆,阿昔替尼的进化史是医疗时代肿瘤药物发展的缩影。随着作用机制的深化、联合疗法的拓展和可及性的提升,这款药物正逐步实现从“延长生存”到“提高生活质量”再到“追求治愈”的跨越。对于患者而言,了解最新进展、与医生充分沟通、选择个体化治疗方案,是把握生存希望的关键。
参考链接:
1、https://www.inlyta.com/
2、https://www.drugs.com/inlyta.html
3、https://www.ema.europa.eu/en/medicines/human/EPAR/inlyta
4、https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-pembrolizumab-plus-axitinib-advanced-renal-cell-carcinoma
5、https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-avelumab-plus-axitinib-renal-cell-carcinoma


