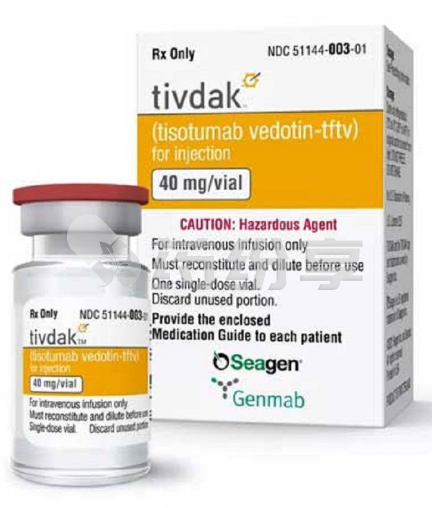
替索单抗(Tivdak)是一种单克隆抗体,用于治疗宫颈癌。它的作用是阻断导致癌细胞生长和繁殖的蛋白质。这有助于减缓或阻止癌细胞的扩散。

替索单抗注射液是一种与液体混合的粉末,由医院或医疗机构的医生或护士在30分钟内静脉注射(进入静脉)。它通常在21天周期的第1天注射。治疗时间的长短取决于你的身体对药物的反应以及你所经历的副作用。
在给予替索单抗 2 mg/kg 一个为期 3 周的周期后,峰值浓度在输注接近结束时达到,而未结合的 MMAE 浓度在替索单抗给药后约两到三天达到峰值。替索单抗的平均 (± SD) C max为 40.8 (8.12) μg/mL,平均 (± SD) AUC 为 57.5 (13.4) 天 x μg/mL。未缀合 MMAE 的平均 (± SD) C max为 5.91 (4.2) ng/mL,平均 (± SD) AUC 为 50 (35.8) 天 x ng/mL。 替索单抗的C max成比例增加,并且没有药物蓄积。一个治疗周期后,替索单抗和未缀合的 MMAE 达到稳态浓度。
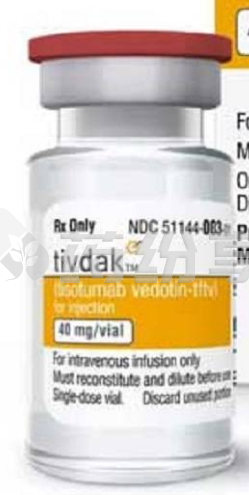
替索单抗目前还没有在国内上市,患者暂时没有办法直接从国内医院进行购买。据了解,替索单抗有在海外上市的原研版,海外上市的原研版替索单抗规格为40m/vial,价格在92000元左右。如果患者有替索单抗方面的问题,请咨询药纷享医学顾问进行了解。