- 相关文章
2021年6月1日,诺华公司宣布美国美国食品药品监督管理局(FDA)已批准苏金单抗(Secukinumab)用于治疗中度至重度斑块型银屑病六岁及以上的儿童患者适合全身治疗或光疗。这是苏金单抗首次在美国儿科人群中获得批准。苏金单抗的临床资料得到了五年成人数据的支持,这些数据显示了对中度至重度斑块型银屑病、银屑病关节炎和强直性脊柱炎的长期疗效和一致的安全性。
“治疗儿童中度至重度斑块型银屑病可能会很复杂,因为需要在提供症状缓解的治疗能力之间取得平衡,同时将安全性作为重中之重,”FAAP FAAD医学博士、MBA、临床试验研究员、德克萨斯大学圣安东尼奥分校儿科和皮肤病学副教授John Browning说。“在儿科pivotal研究中,使用苏金单抗治疗的大多数患者能够获得透明或几乎透明的皮肤,其安全性与之前的成人临床试验一致。由于这种疾病的系统性,对于面临这种挑战性疾病的家庭来说,苏金单抗是一种受欢迎的治疗选择。”
银屑病是一种常见的慢性炎症性疾病,影响着大约800万美国人和1%的美国儿童和青少年。发病最常见于青春期,三分之一的银屑病病例始于儿童时期。银屑病会对儿童的生活质量产生负面影响,尤其是在他们的成长阶段。
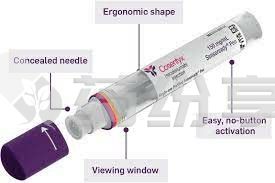
根据给药时儿童的体重,苏金单抗的批准儿科剂量为75 mg或150 mg,并在首次负荷方案后每四周通过皮下注射给药。经过初始咨询和适当的注射技术培训后,成年护理人员可在医疗服务提供者办公室外通过单剂量预充式注射器或Sensoready笔给药。
诺华制药公司总裁Victor Bulto表示:“今天FDA的批准对苏金单抗来说是一个重要的里程碑,表明我们致力于帮助满足儿童斑块型银屑病患者及其家人的需求。“全球100多个国家的400,000多名患者接受了治疗,这一扩大的适应症建立在苏金单抗既定的安全性和有效性基础上。”
苏金单抗的批准基于两项评估6至< 18岁斑块型银屑病儿童使用苏金单抗的III期研究。这些试验中报道的安全性与成人斑块型银屑病试验中报道的安全性一致。没有观察到新的安全信号。
第一项研究评估了疗效和安全性,是一项为期52周(共236周)的随机、双盲、安慰剂和活性对照研究,包括162名6岁及以上患有严重斑块型银屑病的儿童。数据显示,与安慰剂相比,苏金单抗在第12周降低了银屑病的严重程度,如以下批准剂量(小于50千克为75毫克,大于等于50千克为150毫克)的基线体重分层的疗效结果所示:银屑病面积严重指数(PASI) 75反应(55% 75毫克对10%安慰剂(分别为N=22和N=20),86% 150毫克对19%安慰剂(分别为N=21和N=21),70%总苏金单抗对15%总安慰剂 和研究者的全球评估修正2011 (IGA)“清晰”或“几乎清晰”皮肤反应(32% 75毫克对5%安慰剂,81% 150毫克对5%安慰剂,56%总苏金单抗对5%总安慰剂),研究的共同主要终点。
第二项III期研究是一项为期208周的随机开放试验,受试者为84名6岁及以上中度至重度斑块银屑病患者。
苏金单抗已经在国内上市,并且已经纳入医保,批准的药品名及商品名为司库奇尤单抗注射液 (可善挺),所以患者可以在国内药房进行购买,价格大约1400元左右,由于各地医保政策的不同,报销比例也不同,请咨询当地医院药房或者医保局。国外的苏金单抗只有原研药,价格比较便宜的是土耳其原研药,价格在1500元左右,和国内纳入医保的苏金单抗价格相差无几,二者药物成分也基本一致,所以患者可以在国内购买。


